
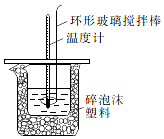
 某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2-t1)℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
分析 (1)根据中和热的测定原理分析解答;
(2)没有用水洗涤温度计上的盐酸溶液,导致盐酸的物质的量偏小,放出的热量偏小;
(3)Q=m•c•△T,反应的△H=-$\frac{Q}{n}$,据此计算;
(4)测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小.
解答 解:(1)中和热的测定须测量酸碱反应的热效应,使用环形玻璃搅拌棒能使溶液上下混合均匀,保证溶液上下的温度达到一致,减少实验误差,
故答案为:使酸和碱充分混合,加快反应速率,并使小烧杯内液体温度上下一致;
(2)没有用水洗涤温度计上的盐酸溶液,导致盐酸的物质的量偏小,放出的热量偏小,测得的中和热数值偏小,故答案为:偏小
(3)始平均温度为t1℃,反应后最高温度为t2℃,温度差为:(t2-t1)℃,50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行中和反应生成水的物质的量为0.05L×1.0mol/L=0.005mol,溶液的质量为100g,温度变化的值为:(t2-t1)℃,平均值为$\frac{6.7+6.8+6.9}{3}$℃=6.8℃,放出的热量为Q=m•c•△T=100g×4.18×10-3kJ/(g•℃)×(t2-t1)℃,所以实验测得的中和热△H=-$\frac{100×4.18×1{0}^{-3}×6.8}{0.005}$=-56.8 kJ/mol;
故答案为:-56.8 kJ•mol-1.
(4)测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小;
故答案为:偏小.
点评 本题考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热测定原理以及测定中和热的误差等问题,试题有利于培养学生灵活应用所学知识的能力.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,可用焦炭和石英砂(SiO2)制取高纯度硅 | |
| B. | CO2和钠在一定条件下可以得到金刚石和碳酸钠,反应中氧化剂和还原剂之比是4:1 | |
| C. | 用高纯度硅作为光导纤维的主要材料 | |
| D. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2[CuCl2溶液] | B. | AgNO3[Ag2O] | C. | NaCl[HCl溶液] | D. | CuSO4[CuSO4] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发皿蒸发溶液时,边加热边用玻璃棒搅拌,直到液体全部蒸干 | |
| B. | 蒸馏操作时,应将温度计插入蒸馏烧瓶内混合溶液中 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+2Ag+═Cu2++2Ag Cu+2AgCl═CuCl2+2 Ag | |
| B. | CO32-+2 H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Al3++3OH-═Al(OH)3↓ Al( NO3)3+3NH3•H2O═Al(OH)3↓+3NH4NO3 | |
| D. | H++OH-═H2O Ba(OH)2+2HNO3═Ba(NO3)2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/min | n(X)/mol | n(Y)/mol | n(Z)/mol |
| 0 | 0.80 | 1.00 | 0 |
| 1 | 0.70 | 0.80 | |
| 5 | 0.70 | ||
| 9 | 0.40 | ||
| 10 | 0.40 | 0.80 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com