
| A、CaO+H2O═Ca(OH)2 |
| B、C+H2O═CO+H2 |
| C、2F2+2H2O═4HF+O2 |
| D、3NO2+H2O═2HNO3+NO |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、小苏打溶液中加入过量的烧碱溶液:HCO3-+OH-═CO32-+H2O |
| B、澄清石灰水中通入过量的CO2:CO2+OH-═HCO3- |
| C、Cl2与水反应生成盐酸和次氯酸Cl2+H2O═H++Cl-+HClO |
| D、向氯化铝溶液中加入足量氨水:Al3++4NH3?H2O═AlO2-+2H2O+4NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐类的水解实质上是破坏了水的电离平衡,促进了水的电离 |
| B、沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 |
| C、原电池的正极一定是化学性质较不活泼的金属 |
| D、在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中相对位置如图所示.Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )| A、原子半径:Z>Y>X |
| B、氢化物稳定性:X<Y |
| C、氢化物沸点:Z>Y |
| D、最高价氧化物对应的水化物酸性:W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、②④ | C、①② | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测定中和热时,所用稀NaOH溶液和HCl的物质的量恰好相等以减小实验误差 |
| B、向Fe(OH)3胶体中通电,一段时间后,阴极附近颜色加深 |
| C、向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体 |
| D、用乙醇萃取溴水中的溴时,分液时有机层从分液漏斗上口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合溶液中c(K+)为3mol?L-1 |
| B、上述电解过程中共转移1mol电子 |
| C、电解得到的Cu的物质的量为0.5mol |
| D、电解后溶液中c(H+)为2mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
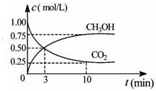
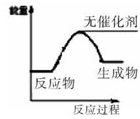 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.
| ||
| ||
| ||
| 太阳光 |
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com