
分析 (1)H2的燃烧热为-285.8kJ•mol-1,据此书写热化学方程式;
CO的燃烧热为-283.0kJ•mol-1,故热化学方程式为①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ/mol,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol,
③H2O(l)=H2O(g)△H=+44.0KJ•mol-1,-1×①+②+③得,CO2(g)+H2(g)?CO (g)+H2O(g)据此进行分析;
(2)提高CO2的转化率,可以使平衡正向进行,根据化学平衡移动原理来回答判断,注意只增大CO2的浓度,平衡向正反应方向移动,但CO2的转化率会降低;
(3)w=$\frac{变化量}{起始量}×100%$;k=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$;w=$\frac{变化量}{起始量}×100%$据此进行计算.
解答 解:(1)H2的燃烧热为-285.8kJ•mol-1,故热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol;CO的燃烧热为-283.0kJ•mol-1,故热化学方程式为①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0KJ/mol,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol,
③H2O(l)=H2O(g)△H=+44.0KJ•mol-1,-1×①+②+③得,CO2(g)+H2(g)?CO (g)+H2O(g)△H=+41.2KJ/mol,
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol;+41.2;
(2)A.该反应前后气体的体积不变,增加压强,该平衡会不会发生移动,CO2的转化率不变,故A错误;
B.正反应为吸热反应,升高温度,化学平衡向正反应方向移动,CO2的转化率降低,故B正确;
C.增大CO2的浓度,可通入CO2,虽然平衡向正反应方向移动,但CO2的转化率反而降低,故C错误;
D.投料比不变,增加反应物的浓度,虽然平衡正向移动,但CO2的转化率反而降低,故D错误;
故答案为:B;
(3)设CO2和H2初始投料分别为1ml,1mol,
CO2(g)+H2(g)?CO (g)+H2O(g)
开始(n) 1 1 0 0
变化 2×25% 2×25% 2×25% 2×25%
平衡 0.5 0.5 2×25% 2×25%
w(CO2)=$\frac{变化量}{起始量}×100%$=$\frac{2×25%}{1}$×100%=50%;k=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$=$\frac{\frac{2×25%}{V}×\frac{2×25%}{V}}{\frac{0.5}{V}×\frac{0.5}{V}}$=1;
(3)设CO2和H2初始投料分别为1ml,2mol,CO2转化x,
CO2(g)+H2(g)?CO (g)+H2O(g)
开始(n) 1 2 0 0
变化 x x x x
平衡 1-x 2-x x x,;k=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$=$\frac{\frac{x}{v}×\frac{x}{v}}{\frac{2-x}{v}×\frac{1-x}{v}}$=1,解得x=0.667,
w(CO2)=$\frac{变化量}{起始量}×100%$=$\frac{0.667}{1}×100%$=66.7%,
故答案为:50%;1;66.7%.
点评 本题考查热化学方程式的书写,转化率及平衡常数的计算,本题侧重考查学生计算能力与分析能力,本题难度中等.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
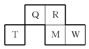 Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )
Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍.下列说法正确的是( )| A. | MW6中各原子核外均满足8电子稳定结构 | |
| B. | Q、W的单核离子的核外电子数相等 | |
| C. | 五种元素均能形成氢化物 | |
| D. | W的氢化物水溶液酸性最强,说明W的非金属性在五种元素中最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH+3O2=2CO2+3H2O△H=-1367.0 kJ•mol-1 | |
| B. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.3 kmol-1 | |
| C. | S(s)+O2(g)=SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO(g)+O2(g)=2NO2(g)△H=-116.2 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 各电子层的电子数 | |||
| K | L | M | N | |
| A | 2 | 7 | ||
| B | 2 | 8 | 1 | |
| C | 2 | 8 | 18 | 7 |
| D | 2 | 8 | 2 | |
| E | 2 | 8 | 7 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Na2O | NaCl | AlF3 | AlCl3 |
| 920 | 180 | 1291 | 190 |
| BCl3 | Al2O3 | CO2 | SiO2 |
| -107 | 2073 | -57 | 1723 |
| A. | 铝的化合物的晶体中有的是离子晶体 | |
| B. | 表中只有 BCl3和干冰是分子晶体 | |
| C. | 同族元素的氧化物只能形成同类型的晶体 | |
| D. | 不同族元素的氧化物不能形成相同类型晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜锈的主要成分是碱式碳酸铜 | |
| B. | 浓硫酸能干燥气体,说明浓硫酸具有吸水性 | |
| C. | 是否具有丁达尔效应是胶体与溶液、浊液的根本区别 | |
| D. | 明矾可用作净水剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com