
![]() 是一种重要的磁性材料,其部分生产工艺流程如图:
是一种重要的磁性材料,其部分生产工艺流程如图:
![]()
(1)已知:
① ![]()
![]()
![]() ;△H1
;△H1
② ![]() ;△H2
;△H2
③ ![]() ;△H3
;△H3
④![]() ;△H4
;△H4
用△H1、△H2、△H3表示△H4,则△H4= 。
(2)若①建立了平衡,则该反应的平衡常数表达式为K= 。
(3)铁的化合物对许多反应都有催化作用,通过测量相同时间内生成![]() 的质量(m),可比较
的质量(m),可比较![]() 、
、![]() 、
、![]() 对
对![]() 分解的催化效果,每次实验均取10mL
分解的催化效果,每次实验均取10mL![]() 溶液,
溶液,
以下是实验数据。
|
实验 编号 |
催化剂 | 反应时间和m(O2)/g | |||||
| 10s | 20s | 30s | 40s | 50s | 60s | ||
| 1 |
| 0.055 | 0.215 | 0.290 | 0.310 | 0.320 |
0.320 |
|
2 |
| 0.053 |
0.220 | 0.291 |
0.310 | 0.320 |
0.320 |
|
3 |
| 0.065 | 0.270 | 0.300 | 0.320 | 0.320 |
0.320 |
①实验开始时,称取了相同质量的三种催化剂(颗粒大小相同),此时还需控制的条件是 。
②分析表中数据,就三种催化剂的催化效果,你所得出的结论是: 。
③根据实验1中的数据,计算在10s~20s内,以![]() 变化表示的反应速率v(H2O2),写出计算过程(忽略溶液体积变化)。
变化表示的反应速率v(H2O2),写出计算过程(忽略溶液体积变化)。
1) △H4= (3分)
(2)k = (3分)
(3)
①反应的温度、过氧化氢的浓度。(3分) (答对一项得1分,答对二项得3分)
②MnO2 的催化效果最好,α-Fe2O3、γ-Fe2O3的催化效果相当。(意思表达正确即可)(3分)
③解:设10~20s内消耗H2O2的物质的量为n 。
10~20s内生成氧气的质量为0.160g。
2 H2O2 =2 H2O + O2
![]() 2mol 32g
2mol 32g
n 0.160g n = = 0.010 mol (2分)
![]() v(H2O2) = = 0.100 mol·L-1·s -1 (2分)
v(H2O2) = = 0.100 mol·L-1·s -1 (2分)
答:v(H2O2)是0.100 mol·L-1·s -1 。
(不带单位运算,不作答,有效数字错误,任一错误,共扣1分)


科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 1 |
| 2 |
| △H2+△H2-△H3 |
| 3 |
| △H2+△H2-△H3 |
| 3 |
| c(H2O) |
| c(H2) |
| c(H2O) |
| c(H2) |
| 实验 编号 |
催化剂 | 反应时间和m(O2)/g | |||||
| 10s | 20s | 30s | 40s | 50s | 60s | ||
| 1 | α-Fe2O3 | 0.055 | 0.215 | 0.290 | 0.310 | 0.320 | 0.320 |
| 2 | γ-Fe2O3 | 0.053 | 0.220 | 0.291 | 0.310 | 0.320 | 0.320 |
| 3 | MnO2 | 0.065 | 0.270 | 0.300 | 0.320 | 0.320 | 0.320 |
查看答案和解析>>
科目:高中化学 来源: 题型:
置换反应的通式可表示为:
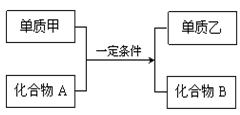
请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为: ;
(2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3![]() Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出该反应的化学方程式: ;
(4)若单质乙是黑色非金属固体单质,化合物B是一种优质的耐高温材料,则该反应的化学方程式为: 。
(5)硅是一种重要的半导体材料,广泛应用于电子工业的各个领域。工业上制取硅单质所用的化合物A是 ,A非常细,导光能力很强,可用作 。
查看答案和解析>>
科目:高中化学 来源: 题型:
置换反应的通式可表示为:
请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为: ;
(2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出该反应的化学方程式: ;
(4)若单质乙是黑色非金属固体单质,化合物B是一种优质的耐高温材料,则该反应的化学方程式为: 。
(5)硅是一种重要的半导体材料,广泛应用于电子工业的各个领域。工业上制取硅单质所用的化合物A是 ,A非常细,导光能力很强,可用作 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省高三上学期期中考试(理综)化学部分 题型:填空题
置换反应的通式可表示为:

请回答下列问题:
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为: ;
(2)若过量的单质甲与化合物A发生反应的化学方程式为: 2Al+Fe2O3 Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
Al2O3+2Fe。该反应可用于焊接铁轨,要除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是: ;
(3)若单质甲是一种常见的金属单质,化合物B是一种磁性黑色晶体,写出该反应的化学方程式: ;
(4)若单质乙是黑色非金属固体单质,化合物B是一种优质的耐高温材料,则该反应的化学方程式为: 。
(5)硅是一种重要的半导体材料,广泛应用于电子工业的各个领域。工业上制取硅单质所用的化合物A是 ,A非常细,导光能力很强,可用作 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com