
| A. | ①>②>③ | B. | ②>①>③ | C. | ③>①>② | D. | ②>③>① |
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 大于水的密度 | B. | 小于水的密度 | C. | 等于水的密度 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强酸性条件下Na+、IO-、K+、可以大量共存 | |
| B. | 在强碱性条件下K+、AlO2-、Na+、NO3-可以大量共存 | |
| C. | 在水溶液中H+、NH4+、SiO32-、Cl-不能大量共存 | |
| D. | 在强酸性条件下NH4+、K+、SO32-、S2-可以大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.5 mol•L-1CuCl2溶液中含有Cu2+的个数为0.5NA | |
| B. | 标况下,22.4L辛烷完全燃烧生成二氧化碳分子为8NA | |
| C. | 1mol Na2O和1mol Na2O2晶体中离子总数均为3NA | |
| D. | 1mol羟基中电子数为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数是60 | B. | 质子数是27 | C. | 中子数是33 | D. | 电子数是33 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
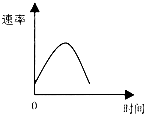 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由下图表示.在下列因素中对产生H2速率有影响的是( )
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由下图表示.在下列因素中对产生H2速率有影响的是( )| A. | ①④ | B. | ③④ | C. | ①②③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 操作及现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2),溶液变为深红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com