
| A.氯化氢、二氧化碳、氢气 |
| B.一氧化碳、氢气、水蒸气 |
| C.一氧化碳、氢气、氨气 |
| D.氯化氢、一氧化碳、水蒸气 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.②①④③ | B.①②③④ | C.③①②④ | D.④③②① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaCl溶液(BaCl2):加入足量Na2CO3溶液,过滤,再向滤液中加适量盐酸并加热 |
| B.KNO3溶液(AgNO3):加入足量KCl溶液,过滤 |
| C.NaCl固体(Na2CO3):加适量稀盐酸,加热蒸发 |
| D.CO2(HCl):将混合气体通过NaHCO3饱和溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
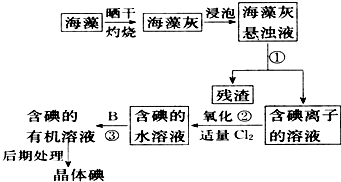
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 浓硫酸 |
| 170摄氏度 |
| 加热 |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
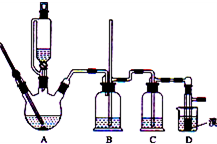
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 |
| B.相对于途径①、③,途径②更好地体现了绿色化学思想 |
| C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②<③ |
| D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
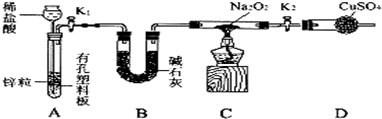
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
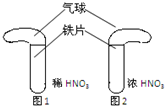
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3 |
| B.热稳定性Na2CO3<NaHCO3 |
| C.常温时水溶性Na2CO3<NaHCO3 |
| D.相对分子质量Na2CO3<NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com