
分析 难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Ca(OH)2能与饱和MgCl2溶液反应生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤、洗涤的方法分离出Mg(OH)2沉淀.
解答 解:难溶电解质的溶度积越小,加入氨水时越易生成沉淀,则生成的沉淀为Cu(OH)2,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;Ca(OH)2能与饱和MgCl2溶液反应生成Mg(OH)2沉淀和氯化钙,氯化钙溶于水,可用过滤、洗涤的方法分离出Mg(OH)2沉淀;
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;饱和MgCl2溶液.
点评 本题考查Ksp的计算,根据溶度积常数确定先沉淀的物质,溶度积常数越小的物质越先沉淀,铜离子和氨水反应生成氢氧化铜和铵根离子.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 所有的非金属元素都分布在p区 | |
| B. | 在CaO和SiO2晶体中都不存在单个小分子 | |
| C. | 单质中一定含有非极性键 | |
| D. | C2H6是碳链为直线型的非极性分子,可推测C3H4也是碳链为直线型的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
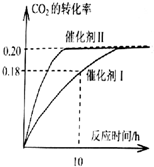 已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.300℃时的恒容密闭容器中,当c(CO2)=1.00mol.L-1、c(H2)=1.60mol.L-1
已知CO2可以生产绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.300℃时的恒容密闭容器中,当c(CO2)=1.00mol.L-1、c(H2)=1.60mol.L-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,过氧化氢
,过氧化氢
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
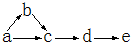 a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:其中:a是单质;b是气体;c、d是氧化物;e是含氧酸.
a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:其中:a是单质;b是气体;c、d是氧化物;e是含氧酸.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com