
 (1)25℃时,0.1mol?L-1的HA溶液中
(1)25℃时,0.1mol?L-1的HA溶液中| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| A- |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| n(H+) |
| n(HA) |
| c(HA) |
| c(A-) |
| 1.8 |
| 1 |
| 2 |
| 9 |
| 2 |


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COO-)<c(Na+) |
| C、c(CH3COO-)=c(Na+) |
| D、无法确定c(CH3COO-)与c(Na+)的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在潮湿的环境中,铜容易发生析氢腐蚀形成铜绿 |
| B、常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、亚硫酸氢钠溶液显酸性:NaHSO3=Na++H++SO32- |
| D、对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b |
| C、NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| D、某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
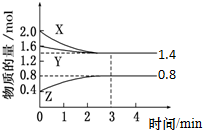 t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )
t℃时,在容积为2L密闭中充入X(g)、Y(g)与Z(g),反应过程中X、Y、Z的物质的量变化如下图所示.下列说法不正确的是( )| A、0~3 min,X的平均反应速率v(X)=0.1 mol?L-1?min-1 |
| B、发生反应的方程式可表示为:3 X(g)+Y(g)?2 Z(g) |
| C、3 min 时,Y的转化率为12.5%,此时,充入惰性气体Ne,转化率不变 |
| D、温度不变,增大Z的浓度,该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
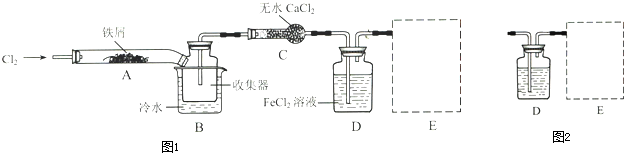
 氯气是一种重要的化工原料.如图为实验室制取氯气的装置.请回答:
氯气是一种重要的化工原料.如图为实验室制取氯气的装置.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德?埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德?埃特尔.他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论.在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示.下列说法正确的是( )| A、NO2是该过程的中间产物 |
| B、NO和O2必须在催化剂表面才能反应催化剂 |
| C、汽车尾气的主要污染成分是CO2和NO |
| D、该催化转化的总反应方程式为:2NO+O2+4CO═4CO2+N2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com