
【题目】下列关于有机物的说法正确的是
A.![]() 的同分异构体中,能与
的同分异构体中,能与![]() 反应生成
反应生成![]() 的有4种
的有4种
B. 该有机物分子中所有碳原子可能在同一平面上
该有机物分子中所有碳原子可能在同一平面上
C.淀粉、纤维素、塑料和氨基酸均属于天然高分子化合物
D.糖类、油脂、蛋白质都是电解质
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】有氯化钠和碘化钠的混合物共26.7 g,溶于水,通入足量氯气后,蒸干、灼烧,固体质量变为 17.55 g。
(1)原混合物中碘化钠的质量是________。
(2)原混合物中氯化钠的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于如下反应,其反应过程的能量变化示意图如图:
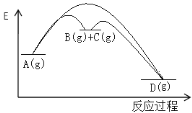
编号 | 反应 | 平衡常数 | 反应热 |
反应① | A(g) | K1 | △H1 |
反应② | B(g)+C(g) | K2 | △H2 |
反应③ | A(g) | K3 | △H3 |
下列说法正确的是
A.K3 =K1 + K2
B. ΔH3=ΔH1 +ΔH2
C.加催化剂,反应①的反应热降低,反应速率加快
D.则增大压强,K1减小,K2增大,K3不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L的恒容容器中,充入1 mol A和3 mol B,并在一定条件下发生如下反应:A(s)+3B(g)![]() 2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
2C(g),若经3 s后测得C的浓度为0.6 mol·L-1,下列选项说法正确的组合是( )
①用B表示的反应速率为0.4 mol·L-1·s-1
②3 s时生成C的物质的量为1.2 mol
③3 s时B的浓度为0.6 mol·L-1
A. ①②B. ①③
C. ②③D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型镁铝合金(Mg17Al12)有储氢性能,它一定条件下完全吸氢的反应为Mg17Al12+17H2═17MgH2+12Al,得到的混合物Y(17MgH2+12Al)能与酸反应释放出大量氢气.下列说法正确的是
A. 该合金应在氮气保护下,将一定比例的Mg、Al单质熔炼而成
B. 合金在吸氢过程中被H2还原
C. 一定量的镁铝合金既可以完全溶于足量盐酸中,也可以完全溶于足量的NaOH溶液中
D. 等质量的镁、铝、和镁铝合金分别与足量的盐酸反应生成H2的体积(同温同压下)由大到小的顺序为:V(Mg)> V(合金)>V(铝)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芜湖市某便利店销售的一种食用碘盐包装袋上有如下标签:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式:____KIO3+____KI+____H2SO4=____K2SO4+_____I2+____H2O
(2)实验室可分离获取单质碘,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把适量碘水和CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开;
H.静置、分层;
①正确的操作顺序是(用编号字母填写)____→____ → ___→A → __→ ___→E→F。
②下列物质,不能作为从水溶液中萃取碘的溶剂是____。
A.苯 B.汽油 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。理论上Na2SO3与I2反应的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是![]()
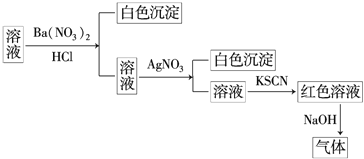
A.原溶液中一定含有![]() B.原溶液中一定含有
B.原溶液中一定含有![]()
C.原溶液中一定含有![]() D.原溶液中一定含有
D.原溶液中一定含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)![]() 2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如下图所示,在t1、t2、t3、t4时刻都只有一个条件发生改变。下列判断正确的是
2B(g)+C(g)+Q(Q>0)的反应速率随时间变化如下图所示,在t1、t2、t3、t4时刻都只有一个条件发生改变。下列判断正确的是
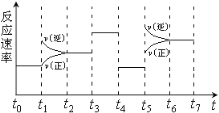
A. t6~t7阶段,C的百分含量最大
B. t2~t3阶段,A的转化率最小
C. t3时,改变因素一定是使用了催化剂
D. t5时,改变因素一定是升高了温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在工业上常用CO与H2合成甲醇,热化学方程式为CO(g)+2H2(g)![]() CH3OH(g) ΔH=-574.4 kJ·mol-1。
CH3OH(g) ΔH=-574.4 kJ·mol-1。
(1)下图是表示一定温度下,在体积为2L的密闭容器中加入5mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。反应第10分钟达到平衡,从反应开始到平衡,用H2表示平均反应速率v(H2)=__mol/(L·min),且反应前后体系的压强之比为____。
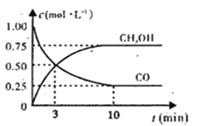
(2)在一容积可变的密闭容器中充有10 mol CO和20 mol H2。CO的平衡转化率与温度(T)、压强(p)的关系如图所示。
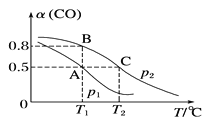
①A、B、C三点对应的平衡常数KA、KB、KC的大小关系为_____。
②若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为__L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com