
【题目】为比较卤素单质的氧化性进行以下实验:①将新制氯水滴入溴化钠溶液中,溶液变黄色;②将新制氯水滴入碘化钾溶液中,溶液变褐色。下列有关说法不合理的是( )
A.①中发生的离子反应为![]()
B.向②所得溶液中再加入![]() 振荡,静默,下层溶液呈紫红色
振荡,静默,下层溶液呈紫红色
C.将①、②可得出结论:氧化性![]()
D.将②中新制氯水换成溴水,若实验现象相同,即可得出氧化性![]()
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B. 反应NH3(g)+HCl(g)===NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C. CH3COOH溶液加水稀释后,溶液中![]() 的值减小
的值减小
D. Na2CO3溶液中加入少量Ca(OH)2固体,CO![]() 水解程度减小,溶液的pH减小
水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用下图所示装置制取氨气 ,并探究其性质。
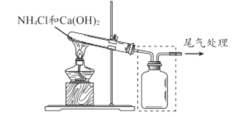
(1)上图试管中发生反应的化学方程式是____________________ 。
(2)请将上图方框中的收集装置补充完整__________________。
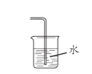
(3)下图是甲同学设计的尾气处理装置,乙同学认为该设计不合理,其理由是_______。
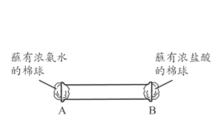
(4)下图所示,将蘸有浓氨水和浓盐酸的棉球分别塞到玻璃管两端的A、B 处,可观察到的现象是___________________。
(5)将上图反应后试管中固体溶于水得到溶液a , 取溶液 a 少许于试管中,_____(填操作和现象),则证明溶液 a 含有![]() 。
。
(6)工业合成氨为人类社会发展做出了巨大贡献。N2 和 H2在催化剂表面合成氨的微观历程及能最变化的示意图如下 ,用![]() )分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)
)分别表示 N2 、H2 、NH3已知工业合成氨:N2(气)+ 3 H2(气)![]() 2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
2NH3 ( 气)是一个放热反应下列说法正确的是 _________________。
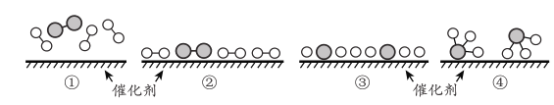
a.使用催化剂,可以加快合成氨的反应速率
b.②→③过程,是吸热过程且只有H - H 键的断裂
c.③→④过程,N 原 子和 H 原子形成了含有极性键的NH3
d.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是:HZO4![]() H2YO4
H2YO4 ![]() H3XO4,下列判断正确的是 ( )
H3XO4,下列判断正确的是 ( )
①阴离子的还原性按X、Y、Z顺序减弱
②单质的氧化性按X、Y、Z顺序增强
③元素的原子半径按X、Y、Z顺序减小
④气态氢化物的稳定性按X、Y、Z顺序减弱
①②A. ②③ B. ①②③ C. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列由电子排布式或排布图所得的结论错误的是( )
选项 | 电子排布式 | 结论 |
A | 1s22s22p | 违背洪特规则 |
B | 1s22s22p63s23p63d3 | 违背能量最低原理 |
C | N的电子排布图: | 违背泡利原理 |
D | 1s22s22p63s23p63d54s1 | 违背能量最低原理 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
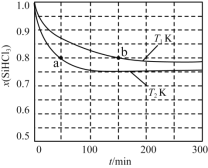
A. 该反应为放热反应,v正,a<v逆,b
B. 化学平衡状态时2v消耗(SiHCl3)=v消耗(SiCl4)
C. 当反应进行到a处时,v正/v逆=16/9
D. T2 K时平衡体系中再充入1 mol SiHCl3,平衡正向移动,x(SiH2Cl2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成了一种能自动愈合自身内部细微裂纹的神奇塑料,合成路线如图所示:
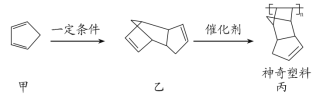
下列说法正确的是( )
A.甲的化学名称为2,4-环戊二烯
B.一定条件下,1mol乙与1molH2加成的产物可能为![]()
C.若神奇塑料的平均相对分子质量为10000,则其平均聚合度约为90
D.甲的所有链状不饱和烃稳定结构的同分异构体有四种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胆矾CuSO4·5H2O可写为[Cu(H2O)4]SO4·H2O,其结构示意图如下:
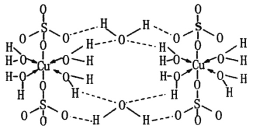
下列有关胆矾的说法正确的是
A.Cu2+的价电子排布式为3d84s1
B.所有氧原子都采取sp3杂化
C.胆矾中含有的粒子间作用力有离子键、极性键、配位键和氢键
D.胆矾所含元素中,H、O、S的半径及电负性依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾长石的主要成分为硅酸盐,由前20号元素中的四种组成,化学式为![]() 其中,只有W显负价.X、Y的最外层电子数之和与Z的最高正价数相等.
其中,只有W显负价.X、Y的最外层电子数之和与Z的最高正价数相等.![]() 与W的阴离子具有相同的电子层结构.X、W的质子数之和等于Y、Z的质子数之和.下列说法错误的是
与W的阴离子具有相同的电子层结构.X、W的质子数之和等于Y、Z的质子数之和.下列说法错误的是![]()
A.W的离子半径![]() 的离子半径
的离子半径
B.Z的氢化物稳定性![]() 的氢化物稳定性
的氢化物稳定性
C.Y的氧化物既能与盐酸,又能与NaOH溶液反应
D.![]() 、
、![]() 两种化合物含有的化学键类型完全相同
两种化合物含有的化学键类型完全相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com