
【题目】阿伏加德罗常数的值为NA,下列说法正确的是( )
A. 标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
B. 1molNa2O2与足量潮湿的CO2充分反应,转移的电子数为2 NA
C. 25℃1LpH=5的CO2溶液中,由水电离出的H+的数目为1×10-5NA
D. 0.1molH2和0.1molI2于密闭容器中充分反应后,容器内分子总数为0.2NA
【答案】D
【解析】
A.0.1mol氯气溶于水,只有少量的氯气与水反应生成氯化氢和次氯酸,所以转移的电子的物质的量小于0.1mol,转移的电子数目小于0.1NA,故A错误;B.过氧化钠和二氧化碳的反应为歧化反应,氧元素由-1价歧化为-2价和0价,故1mol过氧化钠转移1mol电子即NA个,故B错误;C.25℃1LpH=5的CO2溶液中,由水电离出的H+的浓度为1×10-5mol/L,但溶液体积未知,无法确定H+的数目,故C错误;D.氢气和碘的反应为可逆反应,反应原理是:I2(g)+H2(g) ![]() 2HI(g),0.1molH2和0.1molI2于密闭容器中充分反应后,生成的HI分子个数小于0.2NA个,但反应前后分子总数不变,为0.2NA,故D正确;故答案为D。
2HI(g),0.1molH2和0.1molI2于密闭容器中充分反应后,生成的HI分子个数小于0.2NA个,但反应前后分子总数不变,为0.2NA,故D正确;故答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用0.1mol/LNaOH溶液滴定40mL0.1mol/LH2SO3溶液,所得滴定曲线如下图所示(忽略混合时溶液体积的变化)。下列叙述不正确的是

A. H2SO3的Ka1=1×10-2
B. 0.05mol/L NaHSO3溶液的PH=4.25
C. 图中Y点对应的溶液中,3c(SO32-)=c(Na+)+c(H+)-c(OH-)
D. 图中Z点对应的溶液中:c(Na+)> c(SO32-)> c(HSO32-)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
A.硫酸、Na2CO310H2O、Ca(OH)2
B.水、空气、纯碱
C.氧化铁、胆矾、生石灰
D.硝酸、食盐水、烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙醇与浓硫酸共热制乙烯,常因温度过高生成少量SO2,有人设计了如下图所示实验,以验证上述混合气体中是否含有乙烯和SO2 。

(1)装置中X仪器的名称是____;碎瓷片的作用是____;
(2)写出生成乙烯的反应方程式____;
(3)A、B、C、D装置中可盛放的试剂是(从下列所给试剂中选出,填序号)
①NaOH溶液,②品红溶液,③KMnO4酸性溶液,④FeCl3溶液
A.___ B.___ C.___ D.___
(4)能说明SO2气体存在的现象是_______________;
(5)确证含有乙烯的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X、Y、Z的分子式均为C7H8,结构简式如下:

下列说法正确的是( )
A. X、Y、Z均为苯的同系物
B. X、Y、Z分子中的碳原子均处于同一平面
C. X、Y、Z均能使酸性高锰酸钾溶液褪色
D. 1molX、1molY分别与足量溴的四氯化碳溶液反应,均最多消耗2mol Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法不正确的是( )
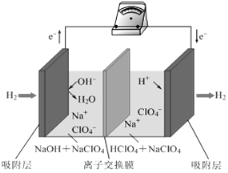
A. 放电时,两极电解质溶液的酸碱性均降低
B. 负极的电极反应是H2-2e-+2OH- ==== 2H2O
C. 电池的总反应是2H2+O2 ==== 2H2O
D. 电解质溶液中Na+向右移动,ClO![]() 向左移动
向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是
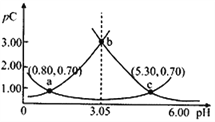
A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 常温下,pKa1(H2A)=5.30,pKa2(H2A)=0.80
C. b点时,![]() =104.50
=104.50
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。

①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com