
����Ŀ�����Բ���A������Ԫ����ɣ�ȡ2.960 g A�������Ŀ����г�����գ��õ�2.400 g����ɫ����B����ɫ�̼�������D������B���������γ��ػ�ɫ��ҺC���ټ���KSCN��Һ��ΪѪ��ɫ������D����ˮ�õ���ɫ������ҺE����E�м�������ĵ⻯����Һ������ɫ���õ���ҺF��ͬʱ��Һ������ǿ����ش��������⣺
��1����ҺCҲ�����ڴ�����ˮ�������ӷ���ʽ��ʾ��ˮ����ԭ����_______________��
��2����֪������A����ϡ���ᷴӦ����Ӧ��õ�dz��ɫ��Һ��ͬʱ����һ�ֵ���ɫ�������һ�ֳ�������ζ���壬д���÷�Ӧ�Ļ�ѧ����ʽ��_______________��
��3�������ӷ���ʽ����E�м�������ĵ⻯����Һ����Һ������ǿ��ԭ��_______________��
���𰸡� Fe3+ + 3H2O![]() Fe(OH)3+ 3H+ ��Fe3+ + 3H2O
Fe(OH)3+ 3H+ ��Fe3+ + 3H2O![]() Fe(OH)3(���壩+ 3H+ Fe3S4+3H2SO4===3H2S��+3FeSO4+S�� H2SO3+I2+H2O===SO42-+4H++2I-
Fe(OH)3(���壩+ 3H+ Fe3S4+3H2SO4===3H2S��+3FeSO4+S�� H2SO3+I2+H2O===SO42-+4H++2I-
��������������������Բ���A������Ԫ����ɣ�ȡ2.960 g A�������Ŀ����г�����գ��õ�2.400 g����ɫ����B����ɫ�̼�������D������B���������γ��ػ�ɫ��ҺC���ټ���KSCN��Һ��ΪѪ��ɫ��˵���ػ�ɫ��ҺC���Ȼ�����Һ��BΪ������������D����ˮ�õ���ɫ������ҺE����E�м�������ĵ⻯����Һ������ɫ���õ���ҺF��ͬʱ��Һ������ǿ�������ƶ�DΪ��������EΪ����������������Ա�������Ϊ���ᣬ�ⱻ��ԭΪ����ᣬ����������ǿ��2.400 g����ɫ�����������ʵ���Ϊ0.015mol�����к���0.03mol����Ԫ�ص�����Ϊ1.68g������Ԫ���غ����2.960 g A�к���Ԫ�ص�����Ϊ1.28g��S �����ʵ���Ϊ0.04mol������A�еĻ�ѧʽΪFe3S4��
��1���Ȼ�����Һ�����ڴ�����ˮ�������ӷ���ʽ��ʾ��ˮ����ԭ��ΪFe3+ + 3H2O![]() Fe(OH)3+ 3H+ ��Fe3+ + 3H2O
Fe(OH)3+ 3H+ ��Fe3+ + 3H2O![]() Fe(OH)3(���壩+ 3H+��
Fe(OH)3(���壩+ 3H+��
��2��������A����ϡ���ᷴӦ����Ӧ��õ�dz��ɫ����������Һ��ͬʱ����һ�ֵ���ɫ���������һ�ֳ�������ζ�������⣬�÷�Ӧ�Ļ�ѧ����ʽΪFe3S4+3H2SO4===3H2S��+3FeSO4+S����
��3��E�м�������ĵ⻯����Һ����Һ������ǿ��ԭ�������ӷ���ʽ�ɱ�ʾΪH2SO3+I2+H2O===SO42-+4H++2I-��


 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɵ��ԭ��ʾ��ͼ��ͼ��ʾ������ܷ�ӦΪ��Zn+2NH4+=Zn2++2NH3��+H2��������˵����ȷ����

A. ����п�̸ɵ��Ϊ���ε��
B. ̼Ϊ��ص�����
C. Zn���Ϸ�����ԭ��Ӧ
D. ��Ӧ2NH4++2e��=2NH3��+H2���ڸ����Ϸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��������ȷ����
A. 1 molҺ̬����������������ȫȼ������ˮ�������ų�642 kJ��������N2H4(l)+O2(g) ===N2(g)+2H2O(g) ��H��+642 kJ��mol��1
B. 12 gʯīת��ΪCOʱ���ų�110.5 kJ��������2C(ʯī��s)+O2(g) ===2CO(g) ��H����110.5 kJ��mol��1
C. ��֪��H2(g)+ ![]() O2(g) ===H2O(l) ��H����286 kJ��mol��1������2H2O(l) ===2H2(g)+O2(g)����H��+572 kJ��mol��1
O2(g) ===H2O(l) ��H����286 kJ��mol��1������2H2O(l) ===2H2(g)+O2(g)����H��+572 kJ��mol��1
D. ��֪N2(g)+3H2(g) ![]() 2NH3(g) ��H����92.4 kJ��mol��1������һ�����������ܱ������г���0.5 mol N2(g)��1.5 mol H2(g)��ַ�Ӧ�ų�46.2 kJ������
2NH3(g) ��H����92.4 kJ��mol��1������һ�����������ܱ������г���0.5 mol N2(g)��1.5 mol H2(g)��ַ�Ӧ�ų�46.2 kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��������ͼ��ʾװ�öԵ������Һ�����Խ���ʵ��̽��������˵������ȷ���ǣ� �� 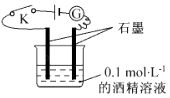
A.�պϿ���K������ ![]() ָ�벻����ƫת��֤���ƾ���Һ�Ƿǵ����
ָ�벻����ƫת��֤���ƾ���Һ�Ƿǵ����
B.�պϿ��أ�����Һ��ͨ����������������ͨ�룬������ʾ�����������ǵ����
C.ȡ��0.1 molL��1��������Һ�滻�ƾ���Һ�������Ƶ�ʾ����ͬ��˵�������Ƿǵ����
D.�պϿ��أ����ձ��м�NaCl���壬��Ȼ�����ܽ⣬���ڲ���Ӧ���ʵ�����ָ�벻����ƫת
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO��һ�����ʻ��õĴ�����Ⱦ�������ܶ����ʷ�����Ӧ��
����2L�ܱ���������800��ʱ��Ӧ��2NO(g)+O2(g)![]() 2NO2 (g)��ϵ����n(NO)��ʱ��ı仯�����
2NO2 (g)��ϵ����n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K=_____����֪��![]() ��
��![]() ����÷�Ӧ��___�ȷ�Ӧ��
����÷�Ӧ��___�ȷ�Ӧ��
��2����ͼ�б�ʾNO2�ı仯��������___________����O2��ʾ��0-2 s�ڸ÷�Ӧ��ƽ������
v =___________��

��3��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����__________��
a����ʱ�����NO2���� b���ʵ������¶�
c������O2��Ũ�� d��ѡ���Ч����
�������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2���䷴ӦΪ��2NO��2CO![]() 2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
2CO2��N2��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�������
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
c(CO)(mol/L) | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
��ش��������⣨���������¶ȱ仯�Դ�����Ч�ʵ�Ӱ�죩��
��1�����������·�Ӧ�ܹ��Է����У���÷�Ӧ����H_____0����д��������������������������
��2���������ܱ������з���������Ӧ���ﵽƽ��ʱ���д�ʩ�����NOת���ʵ���________��
A��ѡ�ø���Ч�Ĵ��� B�����߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶� D����С���������
��3��ijͬѧ���������ʵ�飬ʵ�������Ѿ���������ʵ����Ʊ��У������������ǿ��Կ�����ͬѧ��ʵ��Ŀ����Ҫ���о�_______________��_____________________�Ի�ѧ��Ӧ���ʵ�Ӱ�졣
ʵ���� | T(��) | NO��ʼŨ(mol/L) | CO��ʼŨ��(mol/L) | �����ıȱ����(m2/g) |
�� | 280 | 1.20��10-3 | 5.80��10-3 | 82 |
�� | 280 | 1.20��10��3 | 5.80��10��3 | 124 |
�� | 350 | 1.20��10��3 | 5.80��10��3 | 124 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��GΪԭ��������������Ķ���������Ԫ�ء�B��C��D������A�γ�10���ӷ��ӣ�E���ʿ�����Ұ�⺸�Ӹֹ��ԭ�ϣ�F��Dͬ���塣
��1��D��E��F�����Ӱ뾶�ɴ�С��˳��Ϊ___________�������ӷ��ţ���
��2��д����֤��G��F�ǽ�����ǿ��һ����ѧ����ʽ��_____________��
��3��F��G�γɵ�һ�ֻ������������ԭ�Ӿ�Ϊ8�����ȶ��ṹ���û�������ˮ��Ӧ����F���ʡ�F����ۺ������G���⻯����ֲ�������ʵ���֮��Ϊ2:1:6���ĵ���ʽΪ_____���÷�Ӧ�Ļ�ѧ����ʽΪ______________��
��4��C�ֱܷ���A��D��ԭ�Ӹ�����1:2�γɻ������Һͱ����ҵĽṹʽΪ________�������£�Һ�������������Ӧ������������Ⱦ�����ʣ��÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ________��
��5����ȡ100 mL1 mol��L��E���Ȼ�����Һ�������м���1 mol��L NaOH��Һ������3.9 g������������NaOH��Һ�������Ϊ____mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�Ϊ1.00 L�������У�ͨ��һ������N2O4��������ӦN2O4(g) ![]() 2NO2(g)�����¶����ߣ�����������ɫ���
2NO2(g)�����¶����ߣ�����������ɫ���
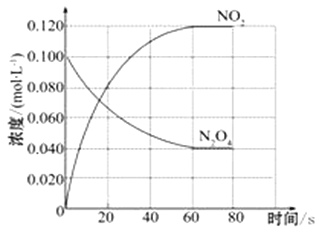
�ش��������⣺
��1����Ӧ�ġ�H___________0������ڡ���С�ڡ�����100��ʱ����ϵ�и�����Ũ����ʱ��仯����ͼ��ʾ����0~60sʱ�Σ���Ӧ����v(N2O4)Ϊ_____________molL-1s-1����Ӧ��ƽ�ⳣ��K1Ϊ______________��
��2��100��ʱ�ﵽƽ��ı䷴Ӧ�¶�ΪT��c(N2O4)��0.0020 molL-1s-1��ƽ�����ʽ��ͣ���10 s�ִﵽƽ�⡣
�� T __________100�棨����ڡ���С�ڡ������ж�������______________________________________��
�� �¶�Tʱ��Ӧ��ƽ�ⳣ��K2 Ϊ ___________________��
��3���¶�Tʱ��Ӧ��ƽ�����Ӧ�������ݻ�����һ�룬ƽ����______________�������Ӧ�����淴Ӧ���������ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������ϩ��������������ȥ��������ϩ�IJ���������
A. ���������ͨ��ʢ�������ϴ��ƿ
B. ���������ͨ��ʢ��ˮ��ϴ��ƿ
C. ���������ͨ��ʢ��������ˮ��ϴ��ƿ
D. ���������ͨ��ʢ�г���ʯ��ˮ��ϴ��ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol��L��1NaOH��Һ��ͨ�������CO2����Һ�д��ڵ���Ҫ���������е�
A. Na����CO32�� B. Na����HCO3�� C. HCO3����CO32�� D. Na����OH��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com