
| A. | 它们都含有 92个中子 | B. | ${\;}_{92}^{235}$U原子核外有143个电子 | ||
| C. | 它们是同种核素 | D. | 它们互为同位素 |
分析 A.中子数=质量数-质子数;
B.原子中质子数=核电荷数=核外电子数;
C.质子数相同,中子数不同属于不同的核素;
D.质子数相同中子数不同的同种元素的不同原子为元素的同位素.
解答 解:A.${\;}_{92}^{235}$U中子数=235-92=143,${\;}_{92}^{238}$U的中子数=238-92=146,中子数不同,故A错误;
B.${\;}_{92}^{235}$U原子核外有92个电子,故B错误;
C.原子中质量数不同属于不同的核素,故C错误;
D.质子数相同,中子数不同是同种元素的不同核素,故D正确;
故选D.
点评 本题考查了原子结构、核素和同位素概念分析、原子中微粒数的计算关系等,掌握基础是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 若C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,则20.0g NaOH固体与稀盐酸完全中和,放出28.65 kJ的热量 | |
| C. | 因为热化学方程式中的化学计量数只表示物质的量,所以化学计量数可以是分数 | |
| D. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥⑧⑩ | B. | ②③④⑤⑨⑩ | C. | ③⑤⑦⑩ | D. | ①③⑤⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 甲烷与O2的燃烧反应 | ||
| C. | 铝与稀盐酸 | D. | 灼热的炭与CO2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
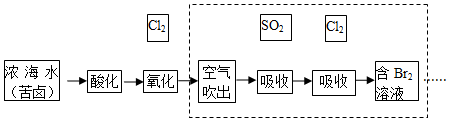
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂.化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂).
、乙:HOOH,式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂.化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;c.将生成的A与H2反应(已知该反应中H2做还原剂).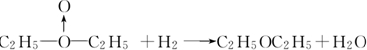 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 废旧轮胎均可直接在室外焚烧处理 | |
| B. | 具有网状结构的酚醛树脂可溶于酒精 | |
| C. | 复合材料玻璃钢具有强度高、质量轻等优点 | |
| D. | 合成纤维、人造纤维和光导纤维均为有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 蛋白质溶液中加入Hg(NO3)2溶液 | 生成沉淀 | 蛋白质发生了盐析 |
| B | FeCl3溶液中加入CaCO3粉末 | 产生气泡 | CaCO3促进Fe3+水解 |
| C | H2C2O4溶液中不断滴加KMnO4溶液 | 褪色速率先慢后快 | H2C2O4浓度越小, MnO4-被还原速率越快 |
| D | 盛有3mL5%CuSO4溶液试管中滴入3~4滴2%NaOH溶液,振荡,再加0.5mL乙醛加热 | 无红色 沉淀 | 乙醛已变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com