
分析 化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断.
解答 解:①c(H2)=c(I2)=c(HI),各组分浓度相等,无法判断各组分浓度是否变化,则无法判断是否达到平衡状态,故①错误;
②c(H2):c(I2):c(HI)=1:1:2,根据各组分的浓度之比无法判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故②错误;
③c(H2):c(I2):c(HI)不再变化,说明正逆反应速率相等,达到了平衡状态,故③正确;
④单位时间内生成nmolH2同时生成2nmolHI,正逆反应速率相等,说明达到平衡状态,故④正确;
⑤单位时间内生成nmolH2同时生成nmolI2,表示的都是逆反应速率,无法判断是否达到平衡状态,故⑤错误;
⑥反应速率v(H2)=v(I2)=$\frac{1}{2}$v(HI),无法判断正逆反应速率是否相等,故⑥错误;
⑦一个H-H键断裂时的同时有两个H-I键断裂,表明正逆反应速率相等,达到了平衡状态,故⑦正确;
⑧温度和体积一定时,容器内压强不再变化,该反应是气体体积不变的反应,无法根据压强判断平衡状态,故⑧错误;
⑨温度和体积一定时,混合气体的颜色不再变化,表明碘单质的浓度不变,则该反应达到平衡状态,故⑨正确;
⑩温度和压强一定时,混合气体的密度不再变化:该反应前后都是气体,容器容积固定,则气体的密度始终不变,无法根据密度判断平衡状态,故⑩错误;
故答案为:③④⑦⑨.
点评 本题考查化学平衡状态的判断,为高频考点,也是学生学习难点,题目难度中等,注意只有反应前后改变的物理量才能作为判断依据,明确化学平衡状态的特征为解答关键,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁 | B. | N2 | C. | 铜 | D. | 硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB族到ⅡB族之间的10个纵行的元素都是金属元素 | |
| C. | 非极性键也可能存在于离子化合物中 | |
| D. | 双原子分子中的共价键,可能是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随着碳原子数的增多,一氯代烃的沸点逐渐升高 | |
| B. | 随着碳原子数的增多,一氯代烃的密度逐渐增大 | |
| C. | 等碳原子数的一氯代烃,支链越多,沸点越低 | |
| D. | 等碳原子数的一卤代烃,卤素的原子序数越大,沸点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
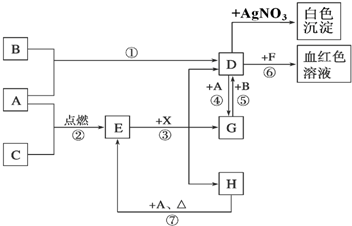
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:在酸性条件下发生的反应为AsO43-+2I-+2H+═AsO33-+I2+H2O,在碱性条件下发 生的反应为AsO33-+I2+2OH-═AsO43-+H2O+2I-. 设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
已知:在酸性条件下发生的反应为AsO43-+2I-+2H+═AsO33-+I2+H2O,在碱性条件下发 生的反应为AsO33-+I2+2OH-═AsO43-+H2O+2I-. 设计如图装置(C1、C2均为石墨电极),分别进行下述操作:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.4g D2气体分子含有的中子数小于0.2NA | |
| B. | 含有0.32g氧元素的二氧化硅中含有的硅氧键数目为0.02NA | |
| C. | 11.2L Cl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA | |
| D. | 7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com