
| 0.2 |
| 0.6 |


科目:高中化学 来源: 题型:
| A、2Na2O2+2H2O═4NaOH+O2↑ |
| B、2F2+2H2O═4HF+O2 |
| C、2Na+2H2O═2NaOH+H2↑ |
| D、NaH+H2O═NaOH+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分离I2和KMnO4两种固体时,可选择加热使I2升华的方法 |
| B、除去AgI胶体中的NaI时,可将其装在用半透膜做的袋子里,放在流动的蒸馏水中,该分离方法称为渗析 |
| C、粗盐水中含有Ca2+、Mg2+、Fe3+、SO42-等离子,可以通过化学沉淀法除去.如:可以通过加入Ba(NO3)2的方法除去其中的SO42- |
| D、从海带中提取碘单质时,可以将其灼烧后加水溶解过滤,在滤液中加适量氯水将碘元素氧化为I2,最后用乙醇萃取出单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、充入少量He使容器内压强增大,平衡向正反应方向移动 |
| B、升高温度,平衡向正反应方向移动,容器内压强一定减小 |
| C、继续加入少量X,X的转化率减小,Y的转化率增大 |
| D、继续加入少量Y,再次平衡时,Y的体积分数一定比上次平衡小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③④ | B、②③ | C、①④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
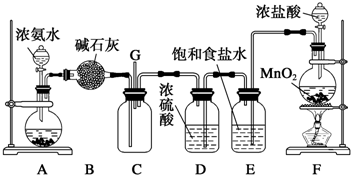
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、回收废旧电池 |
| B、加强燃放烟花爆竹法规 |
| C、停止使用含铅汽油 |
| D、将工厂烟囱加高,减少周围大气污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com