
【题目】汽车尾气中含有CO、NOx等污染物,减少汽车尾气污染是重要研究课题。
(1)已知: N2(g) + O2(g)==2NO(g) △H=+ 180.5kJ·mol-1
2C(s)+ O2(g)== 2CO(g) △H= - 221.0kJ·mol-1
C(s)+ O2(g)==CO2(g) △H= -393.5 kJ·mol-1
2CO(g)+ 2NO(g)== N2(g)+ 2CO2(g) △H=_______kJ·mol-1
(2)某温度下,为探究2CO(g)+ 2NO(g)N2(g)+ 2CO2(g)的反应速率,用气体传感器测得不同时间的CO和NO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO)/10-4mol·L-1 | 36.0 | 30.5 | 28.5 | 27.5 | 27.0 | 27.0 |
c(NO)/10-4mol·L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
①前2s内,上述反应的平均反应速率v(NO)=_______;
②该温度下,上述反应的平衡常数K=_________;
③对于上述反应,下列叙述正确的是________(填字母)。
A.反应在低温下能自发进行 B.当2v正(CO)=v逆(N2)时,反应达到平衡状态
C.研究反应的高效催化剂意义重大 D.反应达到平衡时,CO、NO的转化率相等
(3)CO浓度分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。写出多孔电极a的电极反应式:_________。

【答案】-746.5 3.75×10-4mol·L-1·s-1 5000 AC CO+O2--2e-=CO2
【解析】
(1)△H=-393.5×2-(﹣221.0)-180.5=746.5 kJ·mol-1;
(2)①v(NO)=(10-2.5)×10-4÷2=3.75×10-4mol·L-1·s-1;
②![]() ,
,
③A. 该反应△H<0,△S<0,所以可在低温下自发反应,A正确;
B. 当v正(CO)=2v逆(N2)时,反应达到平衡状态,B错误;
C.高效催化剂可提高反应效率,意义重大,C正确;
D.CO转化率为(9×10-4)÷(36×10-4)=0.25,NO转化率为(9×10-4)÷(10×10-4)=0.9,D错误;
答案选AC;
(3)电极a是原电池负极,发生氧化反应,故电极反应式为CO+O2--2e- =CO2。


科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
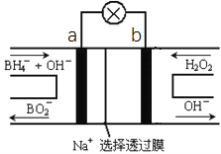
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
C. 电池放电时Na+从b极区移向a极区
D. 电极a采用MnO2,MnO2既作电极材料又有催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命名法写出下列物质名称或结构简式或者对应的化学方程式:
(1)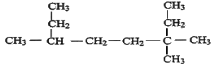 __________
__________
(2)实验室制取乙炔的化学方程式为:___________
(3)乙醇的消去反应:_________________
(4)羧基的结构简式:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用CO、H2制造CH3OCH3有三个途径:
CO(g)+H2(g)═CH3OH(g) △H1=-91kJmol-1 平衡常数K1
2CH3OH(g)═CH3OCH3(g)+H2O △H2=-24kJmol-1 平衡常数K2
CO(g)+H2O(g)═CO2(g)+H2(g) △H3=-41kJmol-1 平衡常数K3
新工艺的总反应式为3CO(g)+3H2(g)═CH3OCH3(g)+CO2(g)则该反应的△H=_____,化学平衡常数为K=__(用K1、K2、K3的代数式表示);
(2)一定条件下气体A与气体B反应生成气体C,反应过程中反应物与生成物的浓度随时间变化的曲线如图.此反应在达到平衡时,A的转化率为__;

(3)研究减少有毒气体的排放对改善环境消除雾霾有十分重要的意义。利用I2O5消除CO污染的反应为:5CO(g)+I2O5(s)5CO2(g)+I2(s) △H。不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。

请回答:
①该反应属于__反应(填“放热”或“吸热“);
②从反应开始至a点时的反应速率为v(CO)=___,b点时化学平衡常数Kb=__;
③下列说法不正确的是____(填字母序号)。
a.容器内气体密度不变,表明反应达到平衡状态
b.两种温度下,c点时体系中混合气体的压强相等
c.增大d点的体系压强,CO的转化率不变
d.b点和d点的化学平衡常数:Kb<Kd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可充电钠-CO2 电池示意图如下,放电时电池总反应为: 4Na+3CO2=2Na2CO3+C.下列说法正确的是
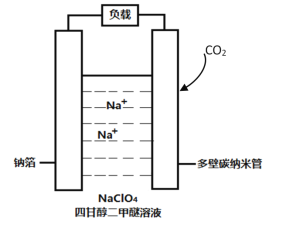
A.该电池也可用水作溶剂
B.放电时,正极的电极反应为:4Na++ 3CO2+ 4e- = 2Na2CO3+C
C.充电时,钠箔与外接电源的正极相连
D.每吸收1molCO2,理论上电路中转移4 mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SF6可用作高压电力设备中的“气体绝缘开关”,由S(g)与F2(g)制备SF6(g)的能量变化如图所示,下列说法正确的是
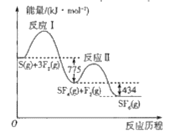
A.若已知S-F键的键能则可确定F-F键的键能
B.S(g)+3F2(g)=SF6(g)△H=+1209kJ·mol-1
C.与S(g)+3F2(g)=SF6(g)相比,S(s)+3F2(g)=SF6(g)放出的热量较多
D.由于反应Ⅰ放出的热量大于反应Ⅱ,所以反应速率:Ⅰ>Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计如下两个实验证明:①氧化性:Fe3+>I2,②反应2Fe3++2I-=2Fe2++I2为可逆反应,下列说法中错误的是
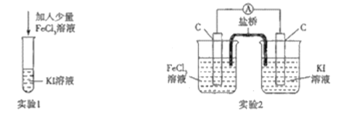
A.实验1试管中加入淀粉后溶液变蓝,该条件下氧化性:Fe3+>I2
B.实验2中最后电流表指针不再偏转可证明上述反应为可逆反应
C.实验1反应结束后,向试管中加入KSCN能判断该反应是否为可逆反应
D.实验2电流表指针不再偏转时,向右侧烧杯中加入单质碘可判断该反应是否为可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脑白金的主要成分的结构简式如图:
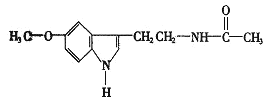
下列对脑白金主要成分的推论错误的是( )
A.其分子式为C13H16N2O2
B.能水解生成乙酸
C.能与溴水发生加成反应
D.其营养成分及官能团与葡萄糖相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com