
| 实验内容 | 实验现象 | 实验结论 |
(1)Na、Mg(条)、K与水反应 | 同一周期自左而右元素原子失电子的能力逐渐______;同一主族自上而下元素原子失电子能力依次______. | |
(2)Mg、Al与酸反应 |


科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 设计这一步骤的目的 |
| 1.将配制的氢氧化钠溶液加热 | |
| 2.在加热后的溶液中滴入酚酞,并在上方滴一些植物油 | |
| 实验方法 | 可能观察到的现象和结论 |
| 方案一:分别配制不同物质的量浓度的氢氧化钠溶液,然后各滴加数滴酚酞溶液。 | 物质的量浓度大的溶液中酚酞红色消失 证明 |
| 方案二:向原红色消失的溶液中加 (填试剂名称) | 红色重新出现,则说明红色消失与氢氧化钠物质的量浓度大小有关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
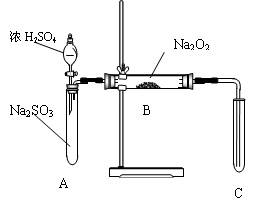
| 实验操作 | 预期现象与结论 |
| 步骤1: | |
| 步骤2: | |
| … | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化 |
| B.取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣 |
| C.取该红色沉淀ag,在空气中充分灼烧至完全变黑,放在干燥器里冷却, 再称重,反复多次至固体恒重,称得质量为bg,比较a,b的关系 |
| D.取该红色沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色 |
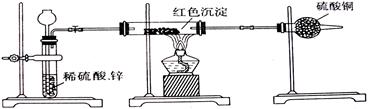
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
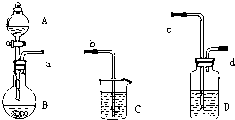
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向盛有0.5mol?L-1 Fe(NO3)2溶液的试管中加入0.5mol?L-1 H2SO4溶液 | 在试管口处出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向PbI2饱和溶液中滴加几滴0.1mol?L-1 KI溶液 | 出现黄色沉淀 | 说明PbI2饱和溶液中有Pb2+存在 |
| C | 向白色ZnS沉淀上滴加0.1mol?L-1 CuSO4溶液,振摇 | 沉淀变为黑色 | ZnS沉淀转化为CuS沉淀 ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq) |
| D | 用1mol?L-1醋酸溶液和1mol?L-1盐酸分别做导电性实验 | 醋酸溶液对应的灯泡较暗 | 醋酸是弱电解质 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
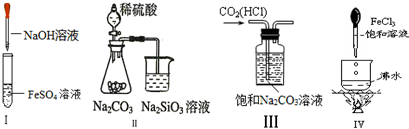
| A.实验Ⅰ:制取纯净氢氧化亚铁 |
| B.实验Ⅱ:证明非金属性强弱:S>C>Si |
| C.实验Ⅲ:除去CO2中的HCl |
| D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com