
| A、氯仿 | B、干冰 | C、石炭酸 | D、白磷 |


科目:高中化学 来源: 题型:
| A、CH4和C2H4 |
| B、CH4和C3H4 |
| C、C2H4和C3H4 |
| D、C2H2和C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A、最高价氧化物对应水化物的碱性A>C |
| B、氢化物的沸点H2D>H2E |
| C、单质与稀盐酸反应的速率A<B |
| D、C2+与A+的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
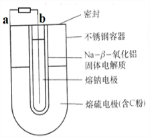
| A、a为电池的正极 |
| B、充电时b接电源的正极 |
| C、正极反应为:nS8+16ne-=8Sn2- |
| D、Na+可以穿过固体电解质和硫反应从而传递电流 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、由MgCl2制取Mg是放热过程 |
| B、热稳定性:MgI2>MgBr2>MgCl2>MgF2 |
| C、常温下氧化性:F2<Cl2<Br2<I2 |
| D、由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s)+Cl2(g)═MgCl2(s)+Br2(g),△H=-117kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0L1.0mol/L的Na2SO4水溶液中含有的氧原子数为4NA |
| B、1molNa2O2固体中含离子总数与1molCH4中所含共价键数目相等 |
| C、1molNaClO中所有ClO-的电子总数为26NA |
| D、标准状况下,6.72LNO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com