
 铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.
铜版画的一种制版方法.以沥青涂于薄铜板表面作防腐膜,用刀刻去防腐膜作画,然后放在FeCl3腐蚀液中.刮去膜之处被腐蚀,形成凹线.印刷时凹线可储油墨,在铜版机纸压制下油墨吸于纸上,形成典雅、庄重的铜版画.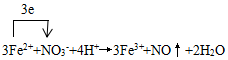 ;
;分析 (1)Fe3+有强氧化性,能把金属铜氧化成铜离子;
(2)加热或形成原电池能加快反应速率;
(3)反应速率太快时,溶解的铜较多;
(4)沥青易溶于有机溶剂;
(5)FeCl3易水解应该加酸抑制水解;
(6)亚铁离子与硝酸反应生成铁离子和NO;
(7)检验三价铁离子用硫氰化钾溶液.
解答 解:(1)Fe3+有强氧化性,能把金属铜氧化成铜离子,自身被还原成 Fe2+,反应方程式为2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)加热能加快化学反应速率,向溶液中加碳粉,碳、Cu、氯化铁溶液三者形成原电池,Cu作负极能加快腐蚀铜的反应速率;
故答案为:AC;
(3)反应速率太快时,溶解的铜较多,不易控制凹线的质量,从而影响版画的质量;
故答案为:反应速率过快不易控制凹线的质量,从而影响版画的质量;
(4)沥青是有机物易溶于有机溶剂,所以选择煤油作溶剂可以除去防腐膜;
故答案为:B;
(5)FeCl3易水解,固体氯化铁配置FeCl3溶液时,将固体氯化铁溶于浓盐酸中,再加水稀释,可以抑制氯化铁的水解;
故答案为:将固体氯化铁溶于浓盐酸中,再加水稀释;
(6)亚铁离子与硝酸反应生成铁离子和NO,反应中Fe元素化合价升高1价,N元素的化合价降低3价,转移的电子数为3,则电子转移的方向和数目为: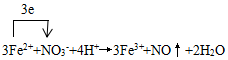 ;
;
故答案为: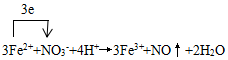 ;
;
(7)检验三价铁离子用硫氰化钾溶液,三价铁离子与硫氰化钾溶液反应会生成红色的溶液;
故答案为:KSCN溶液;溶液呈红色.
点评 本题考查了Cu、Fe以及其化合物的性质、离子检验、氧化还原反应,题目难度中等,侧重于考查学生对基础知识的综合应用能力,注意把握常见离子的检验方法以及氧化还原反应中电子转移的表示方法.


科目:高中化学 来源: 题型:实验题
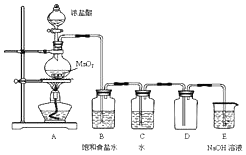 某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.
某化学兴趣小组制备饱和氯水并对饱和氯水与碳酸钙的反应进行研究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
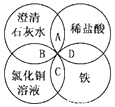 铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题:
铁、稀硫酸、Ba(OH)2溶液、CuSO4溶液是中学化学常见的物质,这四种物质间的反应关系如图所示,图中两圆相交部分(A、B、C、D)表示物质之间可能发生的反应,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
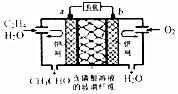 中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途.如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )
中石化于2012年将年产120万吨的乙烯工程落户大庆,乙烯是有机化工工业的重要原料,有很多重要用途.如:乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,在制备乙醛的同时还可获得电能,其总反应化学方程式为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )| A. | 该电池电极a为正极,b为负极 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 负极反应式为:CH2═CH2-2e-+H2O═CH3CHO+2H+ | |
| D. | b电极有2.24LO2反应,溶液中有0.4molH+迁移到b电极上反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 选用试刘 | |
| A | NaBr溶液(NaI) | 溴水 |
| B | CuCl2溶液(FeCl3) | 铜粉 |
| C | 乙烷(乙烯) | 氢气 |
| D | 溴苯(苯) | 液溴 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶于水呈酸性:NaHSO3═Na++H++SO32- | |
| B. | 在Na2S2O3溶液中滴加稀硫酸:2H++S2O32-═SO2↑+S↓+H2O | |
| C. | 浓盐酸与MnO2反应制氯气:MnO2+4HCl═Mn2++2Cl2+2H2O | |
| D. | 工业冶炼Mg:2Mg2++2O2-$\frac{\underline{\;电解\;}}{\;}$2Mg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题:
肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.回答下列问题: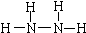 .
.| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(N2) | n(H2) | n(NH3) | |
| 甲 | 1mol | 3mol | 0mol |
| 乙 | 0.5mol | 1.5mol | 1mol |
| 丙 | 0mol | 0mol | 4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com