
【题目】在2 L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=________。已知:K300℃>K350℃,则该反应是________热反应。
(2)图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________。
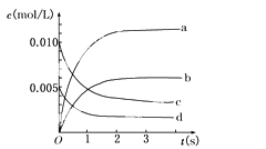
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
e.颜色不再改变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________
a.及时分离出NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
【答案】(1)![]() 放(2)b 1.5×10-3 mol/(L·s)(3)b、c、e(4)c
放(2)b 1.5×10-3 mol/(L·s)(3)b、c、e(4)c
【解析】
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据方程式可知该反应的平衡常数表达式K=![]() 。已知:K300℃>K350℃,这说明升高温度平衡向逆反应方向进行,则该反应是放热反应。
。已知:K300℃>K350℃,这说明升高温度平衡向逆反应方向进行,则该反应是放热反应。
(2)NO2是生成物,在反应过程中浓度是增大的。由表中数据可知,平衡时c(NO)=0.007mol/L÷2L=0.0035mol/L。曲线b平衡时的浓度为0.0035mol/L,根据反应方程式中的化学计量数可知,曲线b表示NO2的浓度变化曲线。反应进行到2s是,NO浓度减少了0.010mol/L-0.004mol/L=0.006mol/L,所以氧气的浓度变化量是0.003mol/L,则氧气的反应速率是0.0030mol/L÷2s=1.5×10-3mol/(L·s)。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.始终都存在v(NO2)=2v(O2)关系,故不能说明到达平衡,a错误;b.随反应进行气体的物质的量减小,压强逐渐减小,因此容器内压强保持不变时,可以说明到达平衡,b正确;c.不同物质表示的正逆速率之比等于化学计量数之比,反应到达平衡,故v逆(NO)=2v正(O2),可以说明到达平衡,c正确;d.反应混合气体的质量不变,容器的体积不变,密度始终不变,故容器内物质的密度保持不变,不能说明到达平衡,d错误;e.颜色的深浅与浓度有关系,颜色不再改变说明NO2浓度不再发生变化,反应达到平衡状态,e正确。答案选bce。
(4)a.及时分离出NO2气体,平衡向正反应移动,但反应速率降低,a错误;b.适当升高温度,反应速率增大,平衡向逆反应移动,b错误;c.增大O2的浓度,反应速率增大,平衡向正反应移动,c正确;d.选择高效的催化剂,增大反应速率,不影响平衡移动,d错误,答案选c。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ( )
A. 0.1(b-2a)mol·L-1 B. 10(2a-b) mol·L-1
C. 10(b-2a) mol·L-1 D. 10(b-a) mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物。试回答下列问题:
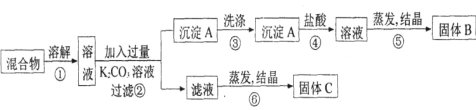
(1) B物质的化学式为 。
(2) 该方案的明显失误是因某一步设计不当而使分离产物不纯,该步骤是 (填序号)如何改进 ,所涉及反应的离子方程式为 。
(3)写出 ② ④ 两步中对应的离子方程式:
② ;
④____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式__________________。
(2)下列三种情况下,离子方程式与(1)相同的是__________(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
若在A项所得溶液中,继续滴加Ba(OH)2溶液,此步反应的离子方程式为:________________
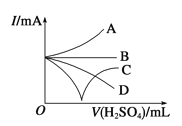
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用右上图中的 曲线表示(填序号)。
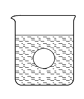
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质的比较正确的是
A. 酸性:H2SiO3>H2CO3 B. 碱性:Mg(OH)2>Al(OH)3
C. 稳定性:SiH4>PH3 D. 原子半径:N>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S===K2S+2NO2↑+CO2↑。被氧化的元素是 ,氧化剂是 ,还原产物是 。电子转移的总数为__________。
(2)国家卫生部在2000年前就决定逐步使用稳定、高效、无毒的二氧化氯取代氯气消毒饮用水。已知二氧化氯溶于水时有亚氯酸根离子(ClO2-)生成,且氧化产物与还原产物的物质的量之比为1∶1。二氧化氯溶于水的反应方程式2ClO2 + H2O=HClO3 + HClO2,请用单线桥标明电子转移方向和数目并指出氧化产物。2ClO2 + H2O=HClO3 + HClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作或对事故的处理方法不正确的是( )
A.给盛有液体的烧瓶加热时,需要加碎瓷片或沸石
B.发现实验室中有大量的可燃性气体泄漏时,应立即开窗通风
C.酒精灯内的酒精不能超过酒精灯容积的2/3
D.不慎将少量浓硫酸溅到皮肤上,应立即用水冲洗,然后涂抹10%的NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com