
为什么离子晶体在固态时不导电,而溶于水后或受热熔化以后可以导电呢?
科目:高中化学 来源: 题型:阅读理解
固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体。这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体。固体电解质取代液体电解质,可以做成全固态电池及其它传感器、探测器等,在电化学、分析化学等领域的应用日益广泛。
银有α、β、和γ等多种晶型。在水溶液中Ag+与I-沉淀形成的是γ-AgI和β-AgI的混合物,升温至136℃全变为β-AgI,至146℃全变为α-AgI。α-AgI是一种固体电解质,导电率为1.31Ω-1?cm-1(注:强电解质水溶液的导电率为10-3~1Ω-1?cm-1)。
4-1γ-AgI和β-AgI晶体的导电性极差。其中γ-AgI晶体属立方晶系,其晶胞截面图如下所示。图中实心球和空心球分别表示Ag+和I-,a为晶胞边长。试指出γ-AgI晶体的点阵型式和Ag+、I-各自的配位数(已知通常I-的半径为220pm,Ag+的半径为100--150pm)。
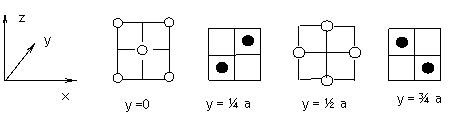 |
4-2α-AgI晶体中,I-离子取体心立方堆积,Ag+填充在其空隙中。试指出α-AgI晶体的晶胞中,八面体空隙、四面体空隙各有多少?
4-3为何通常Ag+离子半径有一个变化范围?
4-4实验发现,α-AgI晶体中能够迁移的全是Ag+,试分析Ag+能够发生迁移的可能原因。
4-5用一价正离子(M)部分取代α-AgI晶体中的Ag+离子,得通式为MAgxI1-x的化合物。如RbAg4I5晶体,室温导电率达0.27Ω-1?cm-1。其中迁移的物种仍全是Ag+。利用RbAg4I5晶体可以制成电化学气敏传感器,下图是一种测定O2含量的气体传感器示意图。被分析的O2可以通过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量。
 |
(1)写出传感器中发生的化学反和电极反应。
(2)为什么由电池电动势的化可以得知O2的含量?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com