
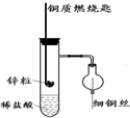
 如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.
如图是实验室用氢气还原氧化铜实验的简易装置.其中的铜质燃烧匙可以在试管M中上下移动,实验时,先将细铜丝一端被弯成螺旋状,先在空气中加热变黑后再迅速伸入球型干燥管中.分析 (1)通过铜质燃烧匙的上下移动来直接控制反应的进行或停止,Zn、Cu和稀硫酸可以形成原电池;
(2)Zn与稀硫酸反应生成氢气,形成原电池时,Cu为正极,正极上氢离子得电子生成氢气.
解答 解:(1)锌粒盛放在铜质燃烧匙中,通过铜质燃烧匙的上下移动来直接控制反应的进行或停止,当锌粒与稀硫酸接触时发生反应会生成氢气,向上移动燃烧匙可以使锌粒与稀硫酸分离,使反应停止,Zn、Cu和稀硫酸可以形成原电池,形成原电池能加快反应速率;
故答案为:控制反应的发生和停止、与锌构成原电池加快反应速率;
(2)Zn与稀硫酸反应生成氢气,所以锌粒表面会有气泡产生,形成原电池时,Zn为负极、Cu为正极,正极上氢离子得电子生成氢气,所以Cu的表面有气泡产生,锌粒被消耗,逐渐变小或消失;
故答案为:铜匙和锌粒表面都有气泡产生;锌粒逐渐变小或消失.
点评 本题考查氢气的制备实验、原电池原理的应用,把握实验原理和原电池原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
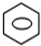 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$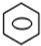 -NO2+H2O
-NO2+H2O ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1mol乙基(-CH2CH3)中含有共价键的总数为7NA | |
| B. | 1L 0.1mol/L盐酸溶液所含HCl的分子数为NA | |
| C. | 标准状况下,11.2L NO2气体中含有的分子数为0.5NA | |
| D. | 标况下11.2L CO和CO2混合气体中,所含碳原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
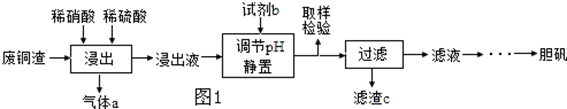
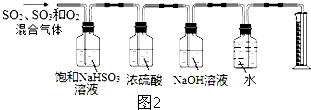
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丁达尔效应鉴别NaCl溶液和KCl溶液 | |
| B. | 向某溶液中加入BaCl2溶液出现白色沉淀,则该溶液中肯定有SO42- | |
| C. | 用KSCN溶液鉴别FeCl2溶液和Fe2(SO4)3溶液 | |
| D. | 用焰色反应可鉴别出NaCl、KCl和Na2SO4三种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与氢氧化镁反应H++OH-=H2O | |
| B. | 铁与稀硝酸反应Fe+2H+=Fe2++H2↑ | |
| C. | 三氯化铁溶液与氨水反应Fe3++3OH-=Fe(OH)3↓ | |
| D. | 过量二氧化碳与石灰水反应 CO2+OH一=HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com