
【题目】改变0.1mol/L二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数![]() 随pH的变化如图所示[已知
随pH的变化如图所示[已知 ]。
]。

下列叙述错误的是
A. pH=1.2时,c(H2A)=c(HA-)
B. lg[K2(H2A)]=-4.2
C. pH =2.7时,c(HA-)>c(H2A)=c(A2-)
D. pH=4.2时,c(HA-)=c(A2-)=c(H+)
科目:高中化学 来源: 题型:
【题目】科学家积极探索新技术对CO2进行综合利用。请回答下列问题:
(1)已知: H2的燃烧热为285.8kJ/mol,C2H4的燃烧热为1411.0kJ/mol,且H2O(g)=H2O(l)ΔH=-44.0kJ/mol,则CO2 和H2反应生成乙烯和水蒸气的热化学方程式为____________,上述反应在__________下自发进行(填“高温”或“低温”)。
(2)乙烯是一种重要的气体燃料,可与氧气、熔融碳酸钠组成燃料电池。写出该燃料电池负极的电极反应式:_______________________.
(3)在体积为1L的密闭容器中,充入3mol H2和1mol CO2,测得温度对CO2的平衡转化率和催化剂催化效率的影响如图所示。
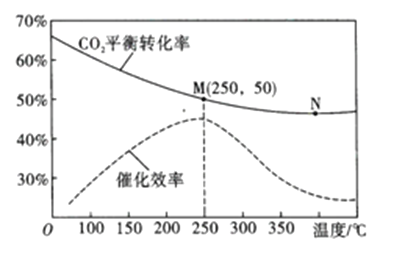
①平衡常数: KM__________KN (填“>”“<”或“=”)。
②下列说法正确的是_________(填序号)。
A.当混合气体密度不变时,说明反应达到平衡状态
B.当压强或n(H2)/n(CO2)不变时,均可证明反应已达平衡状态
C.当温度高于250℃时,因为催化剂的催化效率降低,所以平衡向逆反应方向移动
D.若将容器由“恒容”换为“恒压”,其他条件不变,则CO2的平衡转化率增大
③250℃时,将平衡后的混合气体(不考虑平衡移动) 通入300mL 3mol/L的NaOH溶液中充分反应,则所得溶液中所有离子的浓度大小关系为__________
④图中M点对应乙烯的质量分数为_____________。
(5)达平衡后,将容器体积瞬间扩大至2L并保持不变,平衡向_____移动(填“正向”“逆向”或“不”),容器内混合气体的平均相对分子质量______(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示。已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是

A. 简单离子半径:W>X>Z
B. 最简单气态氢化物的稳定性:Y<Z
C. 化合物XZW中既含离子键又含共价键
D. Y的氧化物能与X的最高价氧化物对应的水化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是
A. 0.2mol/L的NaHCO3溶液中: c(Na+)>c(HCO3-)>c(OH-)>c(H+)
B. 叠氮酸(HN3)与醋酸酸性相近,0.1mol/LNaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
C. 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-)
D. 0.02mol/L的NaOH溶液与0.04mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)= c(HC2O4-)+2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数,则关于热化学方程式 C2H2 (g) +5/2O2 (g) →2CO2 (g)+H2O(l) △H = —1300kJ / mol 的说法中,正确的是 ( )
A. 当8 NA个电子转移时,该反应放出1300kJ的能量
B. 当1 NA个水分子生成且为液体时,吸收1300kJ的能量
C. 当2 NA个碳氧共用电子对生成时,放出1300kJ的能量
D. 当8 NA个碳氧共用电子对生成时,放出1300kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组通过如右图所示装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。

实验操作和现象:
操作 | 现象 |
点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
(1)实验前要首先进行的操作是____________.
(2)现象Ⅰ中白雾的成分是_________(填名称),形成白雾的原因是________.
(3)将现象Ⅰ中得到的黄色气体通入KSCN溶液,溶液变红。则现象Ⅱ中黄色气体除了Cl2还含有________ (填化学式);该物质能使B中KI-淀粉溶液变蓝,发生反应的离子方程式是______.
(4)为了确认现象Ⅱ中黄色气体中含有Cl2,小组提出如下方案:
方案:将B中KI-淀粉溶液替换为NaBr溶液。
现象:B中溶液呈浅橙红色;未检出Fe2+。
a.写出用铁氰化钾溶液检验Fe2+原理的离子方程式:_________
b.方案中检验Fe2+的原因是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com