
分析 (1)①反应中Fe元素化合价升高,C元素化合价降低,计算生成C的物质的量,结合C元素化合价变价计算转移电子物质的量;
②已知:Ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=-76.0kJ•mol-1
Ⅱ.C(s)+2H2O(g)=CO2 (g)+2H2(g)△H=+113.4kJ•mol-1,
根据盖斯定律,(Ⅰ+Ⅱ)×$\frac{1}{2}$可得:3FeO(s)+H2O (g)=Fe3O4 (s)+H2 (g),焓变也进行需要计算;
(2)向一容积为 2L的恒容密闭容器中充人2molCO2和8mol H2,在 300℃时发生上述反应,达到平衡时,测得CH4的浓度为0.8mol•L-1,则:
CO2(g)+4H2 (g)?CH4 (g)+2H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.8 3.2 0.8 1.6
平衡量(mol/L):0.2 0.8 0.8 1.6
代入K=$\frac{c(C{H}_{4})×{c}^{2}({H}_{2}O)}{c(C{O}_{2})×{c}^{4}({H}_{2})}$计算平衡常数,再根据平衡常数相对大小判断温度对平衡移动的影响.
解答 解:(1)①由方程式可知,每生成1mol Fe3O4时生成0.5molC,C元素化合价由+4价降低为0价,故转移电子为0.5mol×4=2mol,故答案为:2;
②已知:Ⅰ.6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=-76.0kJ•mol-1
Ⅱ.C(s)+2H2O(g)=CO2 (g)+2H2(g)△H=+113.4kJ•mol-1,
根据盖斯定律,(Ⅰ+Ⅱ)×$\frac{1}{2}$可得:3FeO(s)+H2O (g)=Fe3O4 (s)+H2 (g),则△H=$\frac{1}{2}$×(-76.0kJ•mol-1+113.4kJ•mol-1)=+18.7kJ•mol-1,
故答案为:+18.7kJ•mol-1;
(2)向一容积为 2L的恒容密闭容器中充人2molCO2和8mol H2,在 300℃时发生上述反应,达到平衡时,测得CH4的浓度为0.8mol•L-1,则:
CO2(g)+4H2 (g)?CH4 (g)+2H2O(g)
起始量(mol/L):1 4 0 0
变化量(mol/L):0.8 3.2 0.8 1.6
平衡量(mol/L):0.2 0.8 0.8 1.6
平衡常数K=$\frac{c(C{H}_{4})×{c}^{2}({H}_{2}O)}{c(C{O}_{2})×{c}^{4}({H}_{2})}$=$\frac{0.8×1.{6}^{2}}{0.2×0.{8}^{4}}$=25,200℃时该反应的平衡常数K=64.8,大于300℃时该反应的平衡常数25,说明降低温度平衡向正反应方向移动,故正反应为放热反应,即Q<0,
故答案为:25;<.
点评 本题考查平衡常数计算及影响因素、反应热计算、氧化还原反应计算,注意对盖斯定律的理解掌握,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 失去电子的反应是还原反应 | |
| B. | 在氧化还原反应中不一定所有的元素的化合价都发生变化 | |
| C. | 做氧化剂的物质不能是还原剂 | |
| D. | 发生还原反应的元素对应产物是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
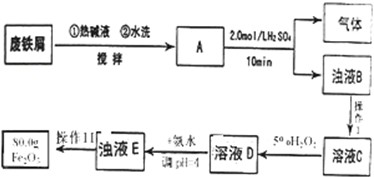
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
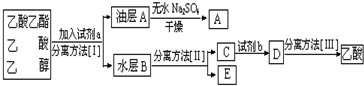
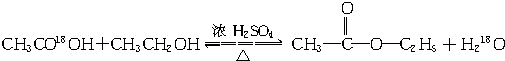 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
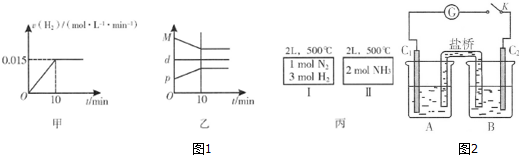
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2、NaOH、HCl、HD四种物质均属于化合物 | |
| B. | 明矾和漂白粉常分别用于自来水的净化和杀菌消毒,两者作用原理不同 | |
| C. | 工业上都采用电解氯化物的方法来制取钠、镁和铝 | |
| D. | SiO2既能与HF反应又能和NaOH反应,所以SiO2属于两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com