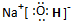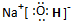������Ԫ��A��B��C��Dԭ��������������B�������������Ǵ�����3������B��2�����Ӳ㣬����������Ϊ6����BΪ��Ԫ�أ�CԪ������������Ӧ��ˮ����ܵ������������ȵ����������ӣ���CΪ��Ԫ�أ�A��Cλ��ͬһ���壬AΪ�ǽ���Ԫ�أ���AΪ��Ԫ�أ�B��C������������֮����D��������������ȣ���D����������Ϊ7��ԭ����������Ԫ�ش���DΪ��Ԫ�أ�E�����������г�������������Ʒ�ڳ�ʪ�������ױ���ʴ������EΪ��Ԫ�أ�
��AΪ��Ԫ�أ�BΪ��Ԫ�أ�CΪ��Ԫ�أ�DΪ��Ԫ�أ�EΪ��Ԫ�أ�
��1��CΪ��Ԫ�أ�����������Ӧˮ����ΪNaOH���������������������ӹ��ɣ�����ʽΪ
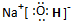
��������������������֮���γ����Ӽ�����������������ԭ������ԭ��֮���γɼ��Լ���
�ʴ�Ϊ��
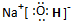
�����Ӽ������Լ���
��2��A��B��C��D����Ԫ���е��������ij���Σ�ˮ��Һ�Լ��ԣ��Ǽ�������������Ҫ�ɷ֣������ΪNaClO���������ƾ���ǿ�����ԣ���������������ⵥ�ʣ���Ӧ�����ӷ���ʽΪ 2I
-+ClO
-+H
2O=I
2+Cl
-+2OH
-��
�ʴ�Ϊ��2I
-+ClO
-+H
2O=I
2+Cl
-+2OH
-��
��3����ʯī�缫���NaCl�ı�����Һ������Ӧ����Һ�����Ϊ200mL�����pHΪ13����c��OH-��=0.1mol/L������n��OH-��=0.2L��0.1mol/L=0.02mol����������������Ӧ������������������2Cl
-+2H
2O
2OH
-+H
2��+Cl
2����֪����������0.01mol��
�ʴ�Ϊ��0.01��
��4��EԪ����DԪ�ؿ��γ�ED
2��ED
3���ֻ�����ֱ�ΪFeCl
2��FeCl
3��
��FeCl
2���ױ�����������FeCl
2��Һʱ��������Һ�м�������Fe���ʣ���ֹFeCl
2���������ʢ���ȷ��
��FeCl
2����ͨ�������Ȼ�����Ӧ���ɣ�FeCl
3����ͨ���Ȼ������������ȷ�Ӧ���ɣ��ʢڴ���
��ͭƬ��̼����FeCl
3��Һ���ԭ��أ�ͭ��������������ͭƬ�ص�������̼�����ʢ���ȷ��
������۵⻯����Һ�μӼ���ED
3��Ũ��Һ���еⵥ�����ɣ��������۳���ɫ��������Һ�еμӼ���ED
3��Ũ��Һ��ԭ��Һ�����ɫ���ʢܴ���
��ѡ���٢ۣ�
��5��25��ʱ����pH=4.00��HCl��ˮ��Һϡ��1.00��10
3������ϡ�ͺ���Һ�и�����Ũ�ȱ���ѭ�Ķ�����ʽ��ϵʽ�� ����غ㣬��c��OH
-��+c��Cl
-��=c��H
+����
��ѡ��c��OH
-��+c��Cl
-��=c��H
+����
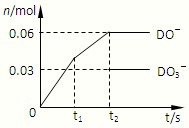
��6��DΪ��Ԫ�أ���һ��������ͨ��һ��Ũ�ȵĿ��Լ���Һ������ǡ����ȫ��Ӧ����֪��Ӧ���̷��ȣ����������������ֺ�DԪ�ص����ӣ���ͼ��֪��ClO
-��ClO
3-���ɣ����ݵ���ת���غ��֪����Cl
-���ɣ�������n��ClO
-��=0.06mol��n��ClO
3-��=0.03mol�����ݵ���ת���غ��֪���ɵ�������n��Cl
-��=0.06mol+0.03mol��5=0.21mol�����������غ��֪n��K+��=n��Cl
-��+n��ClO
-��+n��ClO
3-��=0.21mol+0.06mol+0.03mol=0.3mol�����Ըÿ��Լ���Һ��KOH�������� 0.3mol��56g/mol=16.8g��
�ʴ�Ϊ��16.8��