
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法错误的是

A.该硫酸的物质的量浓度为18.4 mol/L
B.该硫酸常用做干燥剂
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合后所得溶液的浓度大于9.2 mol/L
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源:2017届甘肃省定西市高三上学期第一次月考化学试卷(解析版) 题型:选择题
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )

A. 3 :1 B.2 :3 C.6 :1 D.1 :3
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市高三上第二次月考化学试卷(解析版) 题型:填空题
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
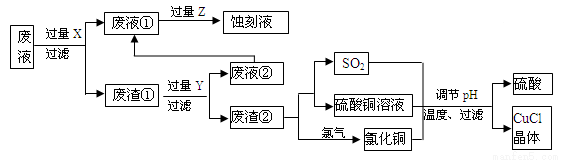
按要求回答下列问题:
⑴ 废液①的主要含有的金属阳离子是__________(填化学符号,下同);废渣①的成分是_____________,Y为__________。
⑵废液①与Z反应的离子方程式为:______________________。
⑶ 写出废渣②生成二氧化硫的化学方程式_____________________。
⑷ 为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
⑸ 生产过程中调节溶液的pH不能过大的原因是___________________。
⑹ 写出产生CuCl的离子方程式_______________________。
⑺ 氯化亚铜的定量分析:
① 称取样品0.25g加入10mL过量的FeCl3溶液250mlL锥形瓶中,不断摇动;
② 待样品溶解后,加水50mL和2滴指示剂;
③ 立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④ 重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 = CuCl2 + FeCl2; Fe2+ + Ce4+ = Fe3+ + Ce3+。
则CuCl的纯度为____________。
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市高三上第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.石灰石、生石灰、熟石灰均属于碱
B.Na2O、MgO、Al2O3均属于碱性氧化物
C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据电解质在水溶液中电离的程度,将电解质分为强电解质和弱电解质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上第一次质检化学试卷(解析版) 题型:填空题
下列所含分子数由多到少的排列顺序是 (用字母排序)
A.标准状况下33.6LH2
B.所含电子的物质的量为4mol的H2
C.20℃时45gH2O
D.常温下,16gO2与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高一上第一次质检化学试卷(解析版) 题型:选择题
已知氨水的密度小于1g/cm3,现将质量分数为15%的氨水与水等体积混合后所得稀氨水的质量分数为
A.7.5% B.大于7.5%. C.小于7.5% D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上9月月考化学卷(解析版) 题型:实验题
燃料电池是符合绿色化学理念的新型发电装置。下图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
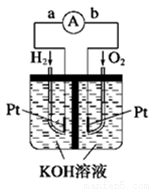
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 ,正极反应式为 ;
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
 2LiH Ⅱ.LiH+H2O
2LiH Ⅱ.LiH+H2O LiOH+H2↑
LiOH+H2↑
反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 ;
(4)如果该电池是甲烷-氧气燃料电池,负极反应式为 ;
(5)如果该电池是肼(N2H4)-氧气燃料电池,负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上9月月考化学卷(解析版) 题型:选择题
100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A.加入适量的6 mol·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
查看答案和解析>>
科目:高中化学 来源:2017届海南中学高三上第二次月考化学试卷(解析版) 题型:填空题
FeCl3是一种重要的化工产品。
(1)电子工业用FeCl3腐蚀铜的原理制造印刷电路板,写出FeCl3与Cu反应的离子方程式:_______________。
(2)某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则可推断溶液中含有的金属阳离子是______________。
在此基础上,又进行了定量组成的测定:
①取50.0 mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g。溶液中c(Cl-)=___________。
②再取50.0 mL待测溶液,向其中加入过量稀硝酸,得到0.448 L(标准状况下)的一种无色气体。写出反应的离子方程式:_____________,待测溶液中c(Cu2+)=_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com