
【题目】氢气因热值高、来源广、产物无污染,常被人们看做一种理想的“绿色能源”,氢气的制取是氢能源利用领域的研究热点。
(1)H2O的热分解可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示。图1中曲线A对应的物质是______________。
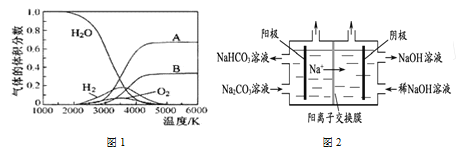
(2)图2为用电解法制备H2,写出阳极的电极反应式:________________。
(3)从可持续发展考虑,太阳能光解水制氢是获取H2的最好途径,但迄今仍然存在诸多问题,如光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等,这些都阻碍了光解水的实际应用,需设计课题进一步研究解决。下列设想符合研究方向的是_________
A 将研究方向专注于紫外光区,无需考虑可见光区
B 研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料
C 研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料
D 研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能
(4)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g) + H2O(g) = CO(g)+ 3H2 (g) ΔH= -206.2 kJmol-1
CH4(g) + CO2 (g) = 2CO(g)+ 2H2 (g) ΔH= -247.4 kJmol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:_________
(5)利用废弃的H2S的热分解可生产H2:2H2S(g) ![]() 2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图3所示:
2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图3所示:
①温度为T4℃时,初始体积为1L,t分钟后,反应达到平衡,该温度下的平衡常数K=________。
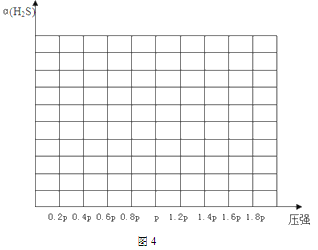
②若保持恒温T℃,将一定量的 H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,试在图4上画出不同起始压强下H2S转化率的趋势图________。
【答案】H(或氢)原子 4CO32- + 2H2O -4e- = O2 + 4HCO3- BCD CH4(g) + 2H2O(g) = CO2(g) + 4H2(g) △H= - 165.0kJ . mol-1 1/45或2.2 ×10-2 
【解析】
(1)由图可知,水的分解化学键断裂先生成H原子与O原子,氢原子结合生成氢气,氧原子结合生成氧气,由水的分子式可知氢原子物质的量是氧原子2倍,故A为氢原子、B为氧原子;故答案为H(或氢)原子;
(2)图2为用电解法制备H2,根据图中信息可知,阳极上碳酸根离子转化为碳酸氢根离子,碳的化合价不变,则应由水电离产生的氢氧根离子失电子产生氧气,结合电子得失知,阳极的电极反应式为:4CO32- + 2H2O -4e-=O2 + 4HCO3-;
(3)A、光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,但催化剂有选择性,不同催化剂的效果不同,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,将研究方向专注于紫外光区,同时也要考虑可见光区,选项A错误;
B、光催化剂能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,必须研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料,选项B正确;
C、研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料,提高能量转化效率,选项C正确;
D、光催化剂能够在可见光区使用的光催化剂不但催化活性低,需使用牺牲剂进行抑制,故需研究新的光解水的催化机制,使利用红外光进行光解水制氢,选项D正确;
答案选BCD;
(4)已知:①CH4(g) + H2O(g)=CO(g)+ 3H2 (g) ΔH1= -206.2 kJmol-1
②CH4(g) + CO2 (g)=2CO(g)+ 2H2 (g) ΔH2= -247.4 kJmol-1
根据盖斯定律,由①![]() 2-②得反应CH4(g) + 2H2O(g)=CO2(g) + 4H2(g) ΔH= ΔH1
2-②得反应CH4(g) + 2H2O(g)=CO2(g) + 4H2(g) ΔH= ΔH1![]() 2-ΔH2= - 165.0kJ . mol-1;
2-ΔH2= - 165.0kJ . mol-1;
(5)①温度为T4℃时,初始体积为1L,t分钟后,反应达到平衡,0.30 mol H2S(g),H2S的转化率为40%,根据反应2H2S(g)![]() 2H2(g)+S2(g)可知,平衡时各物质的量浓度分别为0.18mol/L、0.12mol/L、0.06mol/L,该温度下的平衡常数K=
2H2(g)+S2(g)可知,平衡时各物质的量浓度分别为0.18mol/L、0.12mol/L、0.06mol/L,该温度下的平衡常数K=![]() =1/45=2.2 ×10-2;
=1/45=2.2 ×10-2;
②若保持恒温T℃,将一定量的H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,反应为气体体积增大的反应,随着反应的进行,H2S的转化率增大,当达平衡后,增大压强,平衡逆向移动,H2S转化率减小,故不同起始压强下H2S转化率的趋势图为 。
。


科目:高中化学 来源: 题型:
【题目】七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上有重要的用途。硼镁泥是硼镁矿生产硼砂的废渣,其主要成分是MgCO3,还含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等杂质,工业上用硼镁泥制取七水硫酸镁的工艺流程如图:
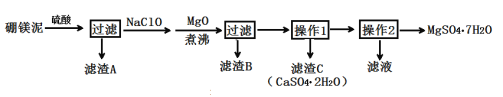
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同温度下的溶解度(g)数据如下表所示:
温度/℃ 物质 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)开始用到硫酸的质量分数为70%,密度为1.61g/cm3,则该硫酸溶液的物质的量浓度为___。
(2)滤渣A中除含少量CaSO4·2H2O外,还有___。
(3)加入MgO后,加热煮沸的目的是___。
(4)若滤渣B的主要成分为Al(OH)3和Fe(OH)3。则加入NaClO发生氧化还原反应的离子方程式为___。
(5)流程中操作1为蒸发浓缩、趁热过滤,这样即可得到CaSO4·2H2O,又防止___。
(6)获取MgSO4·7H2O的操作2为:___、___、过滤洗涤。
(7)已知开始硼镁泥样品的质量为ag,制取七水硫酸镁的质量为bg,据此能计算出硼镁泥中镁元素的含量吗?若能,请写出表达式;若不能,请说明理由。___(能或不能),表达式(或理由)为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知铜在常温下能被HNO3溶解。反应方程式为: 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(1)请将上述反应改成离子方程式,并用单线桥法表示电子得失的方向和数目_______。
(2)若生成0.2mol的NO,则该过程中转移的电子是___________mol。
(3)被还原的硝酸占参加反应硝酸的比例为___________。
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2;已知该反应中H2O2只发生如下过程:H2O2→ O2,写出该化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+ H+,下列说法正确的是
CH3COO-+ H+,下列说法正确的是
A.向体系中加入少量CH3COONa固体,平衡向左移动,c(CH3COO-)下降
B.向体系中加水稀释,平衡向右移动,溶液中所有离子的浓度都减小
C.加入少量NaOH固体(忽略溶解热效应),平衡向右移动,水的电离程度也随之增大
D.升高体系温度(忽略醋酸挥发),溶液中H+数目增多,平衡一定向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
实验流程如下:
C6H12O6溶液![]()
![]()
![]() 滤液
滤液![]() 悬浊液
悬浊液![]()
![]()
![]() Ca(C6H11O7)2
Ca(C6H11O7)2
已知:葡萄糖酸钙微溶于乙醇,可溶于冷水,易溶于热水。则下列说法不正确的是
A.第②步充分反应后CaCO3固体需有剩余,其目的是确保葡萄糖酸完全转化为钙盐
B.第④步加入乙醇的作用是减小葡萄糖酸钙在水中的溶解量,使其结晶析出
C.第⑤步过滤时,发现有固体产品残留在原容器壁上,可加少量热水冲洗再转移至过滤器内
D.可用O2代替Br2,在葡萄糖氧化酶作用下氧化葡萄糖进而制备葡萄糖酸钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某些有机物之间的转化关系图:
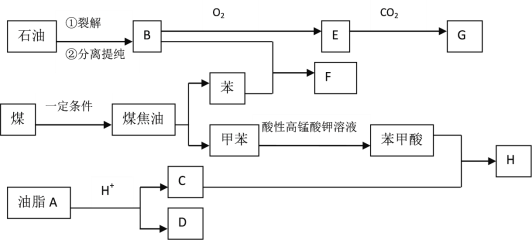
已知:①油脂A的分子式为C57H104O6,且反应生成C、D的物质的量之比为1: 3
②E的分子式为C3H6O,含有甲基且所有碳原子都是饱和碳原子
③G是一种可降解高聚物,其化学式可表示为![]()
试回答下列问题:
(1)G中官能团的名称是_______,D的分子式为_____________,E的结构简式为____________。
(2)下列关于苯甲酸说法正确的是_______
A 其结构式为![]()
B 其苯环上的一氯代物有3种
C 1个分子可与4个氢气分子发生加成反应
D 与图中有机物C反应可得到5种不同的酯类物质(不考虑立体异构)
(3)烃B与苯在一定条件下1:1反应生成F,分析F的1H核磁共振谱图,共有5个吸收峰,且峰面积之比为1:1:2:2:6,写出B与苯反应生成F的化学方程式:____________________________。
(4)写出所有符合下列要求的E的同分异构体(不包括E):_________________________________。
①链状化合物 ②氢谱上只有3组峰 ③分子中不含C=C—OH结构
(5)现有甲苯与C的混合液体,其含碳量为60%。取92g该混合液体完全燃烧,将产物依次通过装有足量浓硫酸和碱石灰的装置完全吸收,则装有浓硫酸的装置质量增重________g,甲苯与C的物质的量之比为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. AlCl3溶液中加入足量的氨水:Al3++4OH-===AlO2-+2H2O
C. 将氯气通入水中:Cl2+H2O===Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吲哚类化合物以其独特的化学结构使其拥有重要的生理活性,在农药、医药、化工、香料和染料等领域发挥着重要的作用。下图是合成“氮-苯甲酰基-2-甲基-3吲哚乙酸甲酯”的路线

已知: 
![]() CH3CH=CHCOOH+CO2+H2O
CH3CH=CHCOOH+CO2+H2O
回答下列问题
(1)B的结构简式为________,B分子中含有的官能团为________(填官能团名称)。
(2)反应③为取代反应,该反应的化学方程式为________。
(3)C的名称为________。
(4)A的结构简式为________,反应⑤的反应类型为________。
(5)B有多种同分异构体,其中与B含有相同官能团的同分异构体有________种。
(6)已知
参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )

A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com