
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)4]溶液,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 受强酸或强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 | |
| C. | 实验室用已知浓度的酯酸溶液滴定未知浓度的氢氧化钠溶液时,选用酚酞做指示剂比用甲基橙做指示剂时带来的误差要大一点 | |
| D. | 自来水厂常用某些含铝或铁的化合物作净水剂,是由于它们具有杀菌作用 |
分析 A.亚铁离子和铁氰化钾溶液反应生成蓝色沉淀;
B.受酸腐蚀应该涂弱碱性物质;
C.滴定未知浓度的氢氧化钠溶液时,反应终点在pH=7~8左右,选用酚酞作指示剂;
D.铝离子、铁离子水溶液中水解生成氢氧化铝、氢氧化铁胶体具有吸附悬浮杂质的作用.
解答 解:A.去锈的绕有细铜丝的铁钉在盐酸溶液中形成原电池,产生亚铁离子速度快,与铁氰化钾溶液反应生成蓝色沉淀所用的时间短,故A正确;
B.受酸腐蚀应涂碳酸氢钠,而不是酸,故B错误;
C.滴定未知浓度的氢氧化钠溶液时,反应终点在pH=7~8左右,选用酚酞作指示剂,滴定终点与反应终点接近误差小,而选甲基橙作指示剂时与反应终点与滴定终点的差距大,则误差大,故C错误;
D.铝离子、铁离子水溶液中水解生成氢氧化铝、氢氧化铁胶体具有吸附悬浮杂质的作用,不具有消毒的功能,但如果是高铁酸盐,则兼具消毒和净水的功能,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,侧重物质的性质及实验技能的考查,注意实验的评价性分析,题目难度不大.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
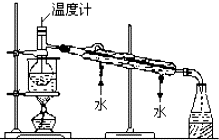 海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:
海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
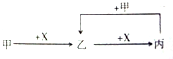
| A. | 甲为C,X为O2 | B. | 甲为Fe,X为Cl2 | ||
| C. | 甲为CO2,X为NaOH溶液 | D. | 甲为HCl,X为Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 验证Br2的氧化性强于l2 | 将少量溴水加入Kl溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| B | 探究石蜡油分解的产物含有烯烃 | 将石蜡油加强热产生的气体通入溴的四氧化碳溶液中 |
| C | 探究蔗糖水解的产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水溶加热几分钟后,再加入新制的氢氧化铜悬浊液并加热 |
| D | 验证Na能置换出醇烃基中的氢 | 向一定量的无水乙醇中加入足量Na,测量生成气体的体积 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 属于芳香烃 | B. | 分子中苯环上的一氯代物有3种 | ||
| C. | 不能与金属钠发生反应 | D. | 不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 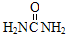 | B. | H2NCH2CH2NH2 | C. | (NH4)2CO3 | D. | Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2O2中既含离子键又含非极性键 | |
| B. | BF3分子中的所有原子共平面 | |
| C. | SiO2和Na2O2的晶体类型相同 | |
| D. | S的第一电离能大于P的第一电离能. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的前四周期五种元素X、Y、Z、M、W.已知X的一种单质是原子晶体,且是自然界中最坚硬的物质,Y原子最外层电子数是次外层的3倍,M与Y同主族,且M元素的单质为淡黄色;Z与M同周期,且Z元素与Y元素可以形成两种化合物,其中一种化合物也为淡黄色;W是生活中使用最广泛的金属元素,且有+2和+3两种常见化合价.据此回答:
原子序数依次增大的前四周期五种元素X、Y、Z、M、W.已知X的一种单质是原子晶体,且是自然界中最坚硬的物质,Y原子最外层电子数是次外层的3倍,M与Y同主族,且M元素的单质为淡黄色;Z与M同周期,且Z元素与Y元素可以形成两种化合物,其中一种化合物也为淡黄色;W是生活中使用最广泛的金属元素,且有+2和+3两种常见化合价.据此回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com