
| A. | c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 使紫色石蕊试液变红的溶液:Na+、Mg2+、NO3-、ClO- | |
| C. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| D. | 碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
分析 A.c(H+)=10-12 mol•L-1的溶液为碱性溶液,四种离子之间不反应,都不与碱性溶液中的氢氧根离子反应;
B.使紫色石蕊试液变红的溶液中存在大量氢离子,次氯酸根离子与氢离子反应;
C.使酚酞试液变红的溶液中存在大量氢氧根离子,铁离子与氢氧根离子反应;
D.碳酸氢钠与氢离子反应生成二氧化碳气体和水.
解答 解:A.c(H+)=10-12 mol•L-1的溶液中存在大量氢氧根离子,K+、Ba2+、Cl-、Br-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.使紫色石蕊试液变红的溶液为酸性溶液,溶液中存在大量氢离子,ClO-与氢离子反应,在溶液中不能大量共存,故B错误;
C.使酚酞试液变红的溶液为碱性溶液,与碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故C错误;
D.碳酸氢钠与H+反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
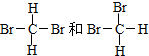 (在横线上填相应的序号)
(在横线上填相应的序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
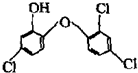 据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )
据报道,高露洁牙膏中含有的消毒剂三氯生遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至癌症,已知三氯生的结构简式如图所示,有关说法正确的是( )| A. | 三氯生的分子式为:C12H6Cl3O2 | |
| B. | 哥罗芳存在同分异构体 | |
| C. | 1mol三氯生最多能与4molNaOH溶液反应 | |
| D. | 三氯生遇FeCl3溶液显紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素中X的气态氢化物最稳定 | |
| B. | X、Y、Z所形成的化合物只含有共价键 | |
| C. | Z的最高价氧化物对应的水化物化学式为H3ZO4 | |
| D. | X与Y可形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | 原子半径大小顺序是:Y>X>R | |
| B. | 其气态氢化物的稳定性顺序是:Z>Y>X>R | |
| C. | X、Y、Z中Z的氧化物对应的水化物的酸性最强 | |
| D. | R的气态氢化物与它的含氧酸之间能发生化学反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com