
 ;
;分析 反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子;
解答 解:①反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为: ,
,
故答案为: ;
;
②反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,当有3mol Cl2生成时,转移5mol电子,所以若有6mol Cl2生成,则有10molHCl被氧化,故答案为:10.
点评 本题考查氧化还原反应知识,注意把握元素化合价的变化,明确电子转移的数目和方向,根据化合价的升降总数计算电子转移的数目,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③① | C. | ②①③ | D. | ①③② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应一定不可以自发进行 | |
| B. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 | |
| C. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
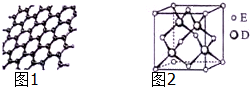 原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:
原子序数依次增大的五种元素A、B、C、D、E位于周期表的前四周期.A基态原子的2p轨道上有2个未成对电子;C的最外层电子数是次外层电子数的3倍,C与D同主族相邻;E位于周期表的ds区,最外层只有一对成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 离子浓度(mol•L-1) | |
| 还原前 | 还原后 | |
| SO42- | 3.20 | 3.50 |
| Fe2+ | 0.15 | 3.30 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com