
【题目】碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱。
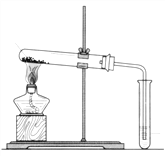
(1)用上图装置分别加热上述两种固体,当观察到澄清石灰水变浑浊时,则试管中受热的固体是_________。通过本实验证明,这两种固体对热的稳定性是Na2CO3 ________于(选填“强”或“弱”)NaHCO3。
(2)若分别向碳酸钠溶液和碳酸氢钠溶液中滴加足量稀盐酸,都能观察到的现象是__________________,其中碳酸氢钠和稀盐酸反应的化学方程式为_______________________________。
(3)钠的化合物中,除了碳酸钠和碳酸氢钠外,还有 _________ 、_________ 等。
【答案】 碳酸氢钠(NaHCO3) 强 产生气泡 NaHCO3 + HCl =NaCl+ H2O + CO2↑ NaNO3 Na2SO4
【解析】(1)NaHCO3受热易分解,Na2CO3受热不分解,碳酸钠较碳酸氢钠稳定,则观察到澄清石灰水变浑浊时,则试管中加热的固体是NaHCO3,故答案为:NaHCO3;强;
(2)二者均与盐酸反应生成二氧化碳,观察到的现象为有气泡冒出,碳酸氢钠与盐酸反应生成氯化钠、水、二氧化碳,其化学反应为NaHCO3+HCl=NaCl+H2O+CO2↑,故答案为:有气泡冒出;NaHCO3+HCl=NaCl+H2O+CO2↑;
(3)氧化钠、氯化钠、过氧化钠、硫酸钠等均为常见的钠的化合物,故答案为:氧化钠;氯化钠;NaNO3;Na2SO4(任选2个即可)


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:①NO+NO2+2OH-=2NO2-+H2O
②气体液化的温度:NO221℃、NO -152℃

(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A 、C、 、 、 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.漂白粉、漂粉精是纯净物
B.漂白粉中含有次氯酸,所以漂白粉能使染料等有机色素褪色
C.工业上将氯气通入澄清石灰水制取漂白粉
D.次氯酸能杀死病菌,所以氯气可用于自来水的消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯酚的叙述错误的是( )
A. 苯酚遇FeCl3溶液显紫色
B. 向苯酚溶液中滴加浓溴水,可观察到白色沉淀
C. 苯酚酸性很弱,不能使紫色石蕊试液变色
D. 苯酚有强腐蚀性,沾在皮肤上可用水洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是( )

A. 当B外接电源负极时,膜的透射率降低,可以有效阻挡阳光
B. 当A接电源的正极时,此时Li+脱离离子存储层
C. 当B外接电源正极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
D. 该电致变色系统在较长时间的使用过程中,离子导体层中Li+的量可保持基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯铁片和纯铜片按下图所示插入同浓度的稀硫酸中一段时间,下列叙述正确的是
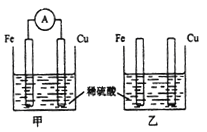
A. 甲装置中电能转化为化学能
B. 两个装置中铜片表面均有气泡产生
C. 甲装置中H+移向铜片发生还原反应
D. 甲中负极上发生的电极反应为Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

(1)氯化水解法生产三氯氧磷的化学方程式为___________________________。
(2)氯化水解法生产三氯氧磷时,会产生含磷(主要为H3PO3、H3PO4等)废水,已知H3PO3是一种淡黄色晶体,且易溶于水的二元弱酸。
①若用20 mL H3PO3溶液与同浓度的NaOH溶液40mL恰好完全反应,生成的盐为___________________(填“正盐”或“酸式盐”)。
②H3PO3中,P元素的化合价为_______________________。H3PO3可以将溶液中的Ag+还原,从而用于化学镀银,写出该离子方程式_________________________。
③处理废水时,先在其中加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸钙沉淀并回收,加入漂白粉的作用是______________________________________。
④若处理后的废水中c(PO43ˉ)=4×10ˉ7mol·Lˉ1,溶液中c(Ca2+)=________mol·Lˉ1。(已知Ksp[Ca3(PO4)2]=2×10ˉ29)
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·Lˉ1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·Lˉ1 NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10ˉ10,Ksp(AgSCN)=2×10ˉ12
①滴定选用的指示剂是__________(选填字母)。
a.FeCl2b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中若未加入硝基苯这项操作,所测Cl元素含量将会_______(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)求该有机物的分子式。
(2)该有机物链状同分异构体的结构简式为: 。
(3) 若有机物A在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com