
分析 (1)五氧化二磷和足量的KOH溶液反应生成磷酸三钾和水;
(2)磷酸三钾和浓磷酸按物质的量比1:2混合生成硫酸二氢钾;
(3)一元中强酸只能电离出一个氢离子;根据化合物中总化合价为0计算出P元素的化合价;根据H3PO2是一元中强酸,可以判断NaH2PO2为正盐;由于为H3PO2为弱电解质,则NaH2PO2为强碱弱酸盐,溶液显示弱碱性;
(4)根据反应物和生成物书写方程式.
解答 解:(1)五氧化二磷和足量的KOH溶液反应生成磷酸三钾和水,离子方程式:P2O5+6OH-=2PO43-+3H2O,
故答案为:P2O5+6OH-=2PO43-+3H2O;
(2)酸三钾和浓磷酸按物质的量比1:2混合生成硫酸二氢钾,离子方程式:PO43-+2H3PO4=3H2PO4-,
故答案为:PO43-+2H3PO4=3H2PO4-;
(3)次磷酸电离方程式:H3PO2?H++H2PO2-,H3PO2中,总化合价为0,其中氢元素为+1价,氧元素为-2价,则P元素的化合价为+1价,由于为H3PO2为弱电解质,则NaH2PO2为强碱弱酸盐,溶液显示弱碱性;
故答案为:H3PO2?H++H2PO2-;+1;正;碱;
(4)白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,反应方程式为2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,
故答案为:2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑.
点评 本题考查了离子方程式、化学方程式的书写,明确物质的性质及发生反应的实质是解题关键,注意盐类水解规律,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
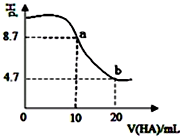 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | HA为强酸 | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | pH=7时,c(Na+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:选择题
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍,Z原子的核外电子数比Y原子少1。下列说法正确的是
A. 元素非金属性强弱:顺序为Z>Y>X
B. Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C. 3种元素的气态氢化物中,Z的气态氢化物最稳定
D. 原子半径大小顺序为:Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol O2和1mol N2所占的体积都约为22.4L | |
| B. | 在标准状况下,H2的气体摩尔体积为22.4L | |
| C. | 在标准状况下,1mol H2和1mol H2O所占的体积都约22.4L | |
| D. | 在标准状况下,22.4L由N2,N2O组成的混合气体中所含有的氮原子的物质的量约为2mol |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是
A.当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B.当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C.当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D.当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com