
| A. | 标准状况下2.24L己烷分子中含1.9NA对共用电子 | |
| B. | 常温下4.4g的CO2和N2O混合物中,所含有的原子数为0.3 NA | |
| C. | 0.1mol Fe与0.1 mol Cl2反应时失电子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32g 电路中就转移NA个电子 |
分析 A、标况下己烷为液态;
B、CO2和N2O的摩尔质量均为44g/mol,且均含3个原子;
C、0.1mol铁和0.1mol氯气反应,铁过量,根据氯气反应后变为-1价来分析;
D、电解精炼铜时,阳极上放电的不止是铜,还有比铜活泼的金属.
解答 解:A、标况下己烷为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、CO2和N2O的摩尔质量均为44g/mol,故4.4g混合物的物质的量为0.1mol,且两者均含3个原子,故0.1mol混合物中含0.3NA个原子,故B正确;
C、0.1mol铁和0.1mol氯气反应,铁过量,而氯气反应后变为-1价,故0.1mol氯气得0.2mol电子,则铁失去0.2mol电子即0.2NA个,故C错误;
D、电解精炼铜时,阳极上放电的不止是铜,还有比铜活泼的金属,故当阳极质量减少32g时,失去的电子多于NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:实验题
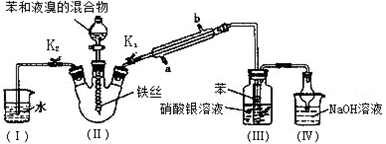
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
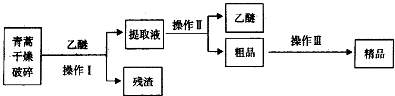
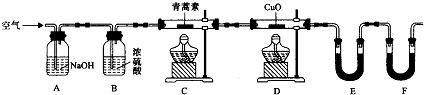
| 装置 | 实验前/g | 试验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③⑤ | C. | ②③④ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠溶解在AlCl3溶液中:2Na+2H2O=2Na++H2↑ | |
| B. | 铝溶解在NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | MgO溶于醋酸中:MgO+2H+=H2O+Mg2+ | |
| D. | Al(OH)3溶于稀硫酸中:OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000A}{22.4}$ | B. | $\frac{1000Aρ}{17A+22.4B}$mol/L | ||
| C. | $\frac{A}{22.4}$mol/L | D. | $\frac{1000ρ}{17A+22.4B}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解,过滤 | B. | 溶解,蒸发浓缩,冷却结晶,过滤 | ||
| C. | 溶解,蒸发结晶 | D. | 溶解,萃取,分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com