
【题目】I.碳元素广泛存在于自然界中,对人类生命和生活具有重要意义。含碳化合物在工业生产和国防建设中有广泛的应用。
(1)碳元素原子核外有_____个未成对电子,最外层有_____种能量不同的电子。CH4 分子的空间构型为_____,是_____分子。(填“极性”或“非极性”)
(2)碳和硅是同主族元素,下列能说明二者非金属性相对强弱的是_____(填编号)
a.CH4的稳定性比SiH4强 b.SiH4的沸点比CH4高
c.碳酸是强酸,硅酸是弱酸 d.碳原子半径比硅原子小
II.氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在800℃氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)该反应的平衡常数表达式K_____。已知平衡常数:K(800℃)>K(850℃),则正反应是__________反应(填“放热”或“吸热”)
(2)任写两种能提高二氧化硅转化率的措施_____、_____。
(3)一定温度下,在2 L密闭容器内,充入一定量的反应物,5分钟时达到平衡,测得容器内气体增加了0.4mol,用CO表示该反应时间内的反应速率为_____。
【答案】 2 2 正四面体 非极性 a c(CO)6/c(N2)2 放热 补充 N2 移去 CO 0.06mol/(L·min)
【解析】I.(1)碳元素基态原子的核外电子排布式为1s22s22p2,原子核外有2个未成对电子,最外层有2种能量不同的电子。CH4分子的空间构型为正四面体,因此是非极性分子。(2)a.非金属性越强,氢化物越稳定,CH4的稳定性比SiH4强能说明二者非金属性相对强弱,a错误;b.SiH4的沸点比CH4高与非金属性强弱没有关系,b错误;c.碳酸是弱酸,c错误;d.碳原子半径比硅原子小与非金属性强弱没有关系,d错误;答案选a;
II.(1)根据方程式可知该反应的平衡常数表达式K=c(CO)6/c(N2)2。已知平衡常数:K(800℃)>K(850℃),这说明升高温度平衡向逆反应方向进行,则正反应是放热反应;(2)正反应是体积增大的放热的可逆反应,因此能提高二氧化硅转化率的措施有补充N2、或移去CO。(3)根据方程式可知每生成6molCO,气体的物质的量增加4mol,因此测得容器内气体增加了0.4mol,则生成CO是0.6mol,浓度是0.3mol/L,所以用CO表示该反应时间内的反应速率为0.3mol/L÷5min=0.06mol/(L·min)。


科目:高中化学 来源: 题型:
【题目】化合物A是近年来采用的锅炉水添加剂,其结构式如图,A能除去锅炉水中溶解的氧气,下列说法正确的是( )
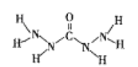
A. A分子中所有原子都在同一平面内
B. A分子中所含的σ键与π键个数之比为10:1
C. 所含C、N均为sp2杂化
D. A与O2反应生成CO2、N2、H2O的物质的量之比为1:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设[aX+bY]为a个X微粒和b个Y微粒组成的一个微粒集合体,NA为阿伏加德罗常数的值。下列说法中正确的是( )
A.0.5mol雄黄(As4S4,已知As和N同主族,结构如图)含有NA个S-S键
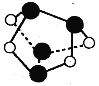
B.合成氨工业中,投料1mol[N2(g)+3H2(g)]可生成2NA个[NH3(g)]
C.用惰性电极电解1L浓度均为2molL-1的AgNO3与Cu(NO3)2的混合溶液,当有0.2NA个电子发生转移时,阴极析出6.4g金属
D.273K,101kPa下,1mol过氧化氢分子中含有的共用电子对数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物甲由四种元素组成。某化学研究小组按如图流程探究其组成:

已知丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一。请回答下列问题:
(1)甲的化学式为____。
(2)甲发生爆炸反应的化学方程式为____。
(3)已知化合物甲中,有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,则爆炸反应中被氧化的元素与还原产物的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基磺酸(H2NSO3H)是一元固体强酸,俗称“固体硫酸”,易溶于水和液氨,不溶于乙醇,在工业上常用作酸性清洗剂、阻燃剂、磺化剂等。某实验室用尿素和发烟硫酸(溶有SO3的硫酸)制备氨基磺酸的流程如图:
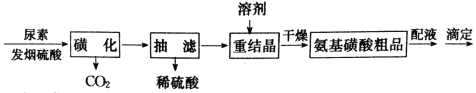
已知“磺化”步骤发生的反应为:
①CO(NH2)2(s)+SO3(g)![]() H2NCONHSO3H(s) ΔH<0
H2NCONHSO3H(s) ΔH<0
②H2NCONHSO3H+H2SO4![]() 2H2NSO3H+CO2↑
2H2NSO3H+CO2↑
发生“磺化”步骤反应的装置如图1所示:请回答下列问题:
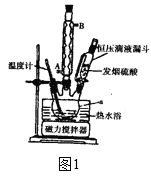
(1)下列关于“磺化”与“抽滤”步骤的说法中正确的是____。
A.仪器a的名称是三颈烧瓶
B.冷凝回流时,冷凝水应该从冷凝管的B管口通入
C.抽滤操作前,应先将略小于漏斗内径却又能将全部小孔盖住的滤纸平铺在布氏漏斗中,稍稍润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上,再转移悬浊液
D.抽滤结束后为了防止倒吸,应先关闭水龙头,再拆下连接抽气泵和吸滤瓶之间的橡皮管
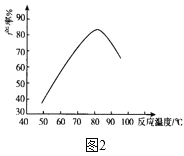
(2)“磺化”过程温度与产率的关系如图2所示,控制反应温度为75~80℃为宜,若温度高于80℃,氨基磺酸的产率会降低,可能的原因是____。
(3)“抽滤”时,所得晶体要用乙醇洗涤,则洗涤的具体操作是____。
(4)“重结晶”时,溶剂选用10%~12%的硫酸而不用蒸馏水的原因是____。
(5)“配液及滴定”操作中,准确称取2.500g氨基磺酸粗品配成250mL待测液。取25.00mL待测液于锥形瓶中,以淀粉-碘化钾溶液做指示剂,用0.08000molL-1的NaNO2标准溶液进行滴定,当溶液恰好变蓝时,消耗NaNO2标准溶液25.00mL。此时氨基磺酸恰好被完全氧化成N2,NaNO2的还原产物也为N2。
①电子天平使用前须____并调零校准。称量时,可先将洁净干燥的小烧杯放在称盘中央,显示数字稳定后按____,再缓缓加样品至所需质量时,停止加样,读数记录。
②试求氨基磺酸粗品的纯度:____(用质量分数表示)。
③若以酚酞为指示剂,用0.08000molL-1的NaOH标准溶液进行滴定,也能测定氨基磺酸粗品的纯度,但测得结果通常比NaNO2法____(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化物是一类重要的化工原料,具有广泛的用途。完成下列填空:
(1)Na2S溶液中,水的电离程度会_________(填“增大”、 “减小”或“不变”);微热该溶液, pH 会_________(填“增大”、 “减小”或“不变”)。
(2)Na2S 溶液中各离子浓度由大到小的顺序为: ___________________________________。
(3)向 Na2S 和 Na2SO3 的混合溶液中加入足量的稀硫酸溶液,发生以下反应:
__ Na2S+ __ Na2SO3+__ H2SO4→__ Na2SO4+__ S↓+ __ H2O
①配平上述化学方程式,标出电子转移的方向和数目______。
②反应中被氧化的元素是______________。
(4)CuS和FeS都是难溶于水的固体,工业上可用 FeS 将废水中的 Cu2+转化为CuS除去,请结合相关原理进行解释:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在方框内填入有机物的结构简式,并回答有关问题:
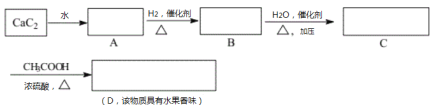
(1)写出A、B、C、D的结构简式:A:___________ B:____________C:___________ D:____________
(2)A→B的化学反应方程式是___________________________,反应类型是___________。
(3) C→D的化学反应方程式是___________________________,反应类型是___________。
(4)B在一定条件下可生成聚合物,其化学方程式是___________________,反应类型是_________。这种塑料会造成白色污染的原因是____________________________。
(5)A在一定条件下也可生成聚合物![]() ,人们发现这种聚合物可以导电,从而具有巨大的应用前景。这一发现在思想观念上给我们的启示是_______________________________________________。
,人们发现这种聚合物可以导电,从而具有巨大的应用前景。这一发现在思想观念上给我们的启示是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列10种物质①熔融的氢氧化钠②蔗糖③纯净的盐酸④金属钠⑤硫酸⑥二氧化硫⑦硫粉⑧偏铝酸钠溶液⑨酒精溶液⑩液氨(注意:下面前三问的答案请填序号!)
(1)属于电解质的有__。
(2)属于非电解质的有__。
(3)上述状态下的电解质能导电的有__。
(4)偏铝酸钠溶液中通足量二氧化碳反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2的催化重整不仅可以得到合成气(CO和H2)。还对温室气体的减排具有重要意义。
CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)= CH4(g) △H=-75 kJ/mol
C(s)+O2(g)=CO2(g) △H=-394 kJ/mol
C(s)+![]() O2(g)= CO(g) △H=-111 kJ/mol
O2(g)= CO(g) △H=-111 kJ/mol
该催化重整的热化学反应方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com