
| A. | 往碘化钠溶液中加入新制氯水可看到有紫黑色固体生成 | |
| B. | 向盛有1mLmol/LMgCl2溶液的试管中滴加1-2滴2mol/LNaOH溶液,有白色沉淀产生,再滴加2滴0.1mol/LFeCl3溶液,白色沉淀转变为红褐色 | |
| C. | 重铬酸钾酸性溶液中加入乙醇,溶液由墨绿色变为橙黄色 | |
| D. | 用石墨作电极电解CuCl2溶液可观察到阳极石墨棒上覆盖一层红色的铜,阴极石墨棒上生成能使湿润碘化钾淀粉试纸变蓝的气体 |
分析 A.碘溶于水,可观察到溶液颜色变化;
B.从难溶电解质的沉淀转化的角度分析;
C.颜色由橙黄色变为灰绿色;
D.用石墨作电极电解CuCl2溶液,阴极发生还原反应生成铜,阳极发生氧化反应生成氯气.
解答 解:A.氯气氧化碘化钠生成碘,溶液由无色变为紫色或褐色,故A错误;
B.盛有1mL 1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置,因氢氧化铁溶解度小于氢氧化镁沉淀,可以观察到白色沉淀转变为红褐色沉淀,故B正确;
C.重铬酸钾与酒精发生氧化还原反应生成铬离子,颜色由橙黄色变为灰绿色,故C错误;
D.用石墨作电极电解CuCl2溶液,阴极发生还原反应生成铜,阳极发生氧化反应生成氯气,故D错误.
故选B.
点评 本题考查较为综合,涉及物质的性质、难溶电解质的溶解平衡、电解等知识,为高考常见题型,侧重考查学生的分析能力和实验能力,注意把握物质的性质以及实验的严密性和可行性的评价,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 产生氯气1.792L | B. | 生成AgCl沉淀11.7g | ||
| C. | 被还原的HCl为0.16mol | D. | 转移的电子数为0.16个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
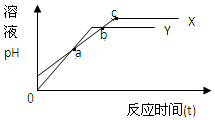 分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )
分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如图.下列说法中不正确的是( )| A. | Y代表盐酸与镁条的反应 | B. | a点时反应Y消耗镁条的量少 | ||
| C. | b点表示此时两溶液pH相等 | D. | c点表示此时反应结束 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
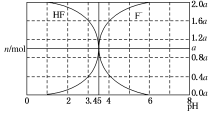 25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )
25℃时,用 2a mol•L-1 NaOH 溶液滴定 1.0L 2a mol•L-1氢氟酸溶液,得到混合液中 HF、F-的物质的量与溶液 pH 的变化如图所示.下列说法正确的是( )| A. | pH=3 时,溶液中:c(Na+)>c(F-) | |
| B. | c(F-)>c(HF)时,溶液一定呈碱性 | |
| C. | pH=4 时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)<2a mol?L-1 | |
| D. | pH=3.45 时,NaOH 溶液恰好与 HF 完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向某无色溶液中滴加氯水后,再滴加淀粉溶液 | 溶液变为蓝色 | 原溶液为KI溶液 |
| B | 向10mL浓度均为0.1mol/L的MgCl2和CuCl2的混合溶液中滴加一滴0.1mol/L的NaOH溶液 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 向某未知溶液中滴加稀盐酸后产生无色气体,气体通入品红溶液中 | 品红溶液褪色 | 原溶液中有SO32- |
| D | 用刚洗净未干燥的容量瓶配制0.1mol/L的NaOH溶液 | 所配制的溶液浓度偏小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
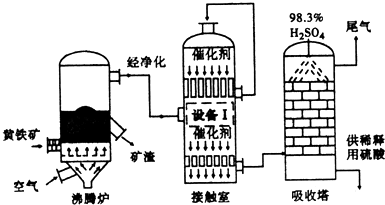
| 截面位置 含量 过程气体流 | 1(接触室人口处) | 2 | 3 | 4 |
| O2物质的量的百分含量 | 11.0% | 10.10% | 8.48% | 8.48% |
| SO2物质的量的百分含量 | 6.00% | 4.04% | 0.51% | 0.51% |
| SO3物质的量的百分含量 | 1.00% | 3.03% | 6.68% | 6.68% |
| N2物质的量的百分含量 | 81.00% | 81.83% | 83.31% | 83.31% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com