

���� �����з�Ӧ��Ļ�ѧ������ΪCuFeS2+S�TFeS2+CuS����ͭ����S�ڸ��������գ�ʹ��ת��ΪFeS2��CuS������HCl��NaCl��CuCl2�����Һ ������ӦCu2++CuS+4Cl-=2[CuCl2]-+S�������˵õ���Һ��ͨ�����������Ӧ4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O��һ���¶��£��ڷ�Ӧ�����õ���Һ�м���ϡ���ᣬ������������ͭ���壬�ᾧ����õ�����ͭ���壬��������ԭ��Һ�õ�ͭ����������õ�FeS��S��
��1�������̿�֪��������ֽ����ɵ�Fe��Cu��Ϊ+2�ۣ�
��2����Ӧ��������ͭ���ӣ�
��3�����Dz�����ܽ�ȣ��ܽ��С���ȴ���Һ��������
��4��FeS2�ڿ����и������գ����ɶ����������������
��5����SO2ͨ��Fe��SO4��3��Һ�У�����������ԭ��Ӧ��������������
������14H++Cr2O72-+6Fe2+�T2Cr3++6Fe3++7H2O��SO2+2Fe3++2H2O=SO42-+2Fe2++4H+����֪��3SO2��Cr2O72-���Դ˼��㣮
��� �⣺ͭ����S�ڸ��������գ�ʹ��ת��ΪFeS2��CuS������HCl��NaCl��CuCl2�����Һ ������ӦCu2++CuS+4Cl-=2[CuCl2]-+S�������˵õ���Һ��ͨ�����������Ӧ4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O��һ���¶��£��ڷ�Ӧ�����õ���Һ�м���ϡ���ᣬ������������ͭ���壬�ᾧ����õ�����ͭ���壬��������ԭ��Һ�õ�ͭ����������õ�FeS��S��FeS2ͨ��������յõ��������Ͷ����������������֣����������Ʊ����ᣬ
��1�������̿�֪��������ֽ����ɵ�Fe��Cu��Ϊ+2�ۣ���ӦI�IJ���ΪFeS2��CuS��
�ʴ�Ϊ��FeS2��CuS��
��2����Ӧ��������ͭ���ӣ������ӷ�ӦΪ4CuCl2-+O2+4H+�T4Cu2++8Cl-+2H2O��
�ʴ�Ϊ��4CuCl2-+O2+4H+�T4Cu2++8Cl-+2H2O��
��3����ͬ����������ͭ���ܽ��С������¶��£�����ͭ���ܽ��С���Ȼ�ͭ��������Ӧ�����õ���Һ�м���ϡ���ᣬ������������ͭ���壬
�ʴ�Ϊ�����¶��£�����ͭ���ܽ��С���Ȼ�ͭ���������ᣬ��������������ͭ���壻
��4��FeS2�ڿ����и������գ����ɶ������������������Ӧ�Ļ�ѧ����ʽΪ��4FeS2+11O2$\frac{\underline{\;����\;}}{\;}$2Fe2O3+8SO2��
�ʴ�Ϊ��4FeS2+11O2$\frac{\underline{\;����\;}}{\;}$2Fe2O3+8SO2��
��5���ٷ���������ԭ��Ӧ�����������������ӷ�ӦΪSO2+2Fe3++2H2O=SO42-+2Fe2++4H+��
�ʴ�Ϊ��SO2+2Fe3++2H2O=SO42-+2Fe2++4H+��
������14H++Cr2O72-+6Fe2+�T2Cr3++6Fe3++7H2O��SO2+2Fe3++2H2O=SO42-+2Fe2++4H+��
��֪��3SO2��Cr2O72-��
3 1
x 0.02mol/L��0.025L
���x=0.0015mol��
��Ӧ������������SO2���������Ϊ��$\frac{0.0015mol}{0.28L/22.4L/mol}$��100%=12.00%��
�ʴ�Ϊ��12.00%��
���� ������ʵ�ʻ�����������ͭ����ۺ����á�Ϊ������������Ԫ�ػ�����֪ʶ�����ӷ���ʽ�ͻ�ѧ����ʽ����д���йؼ��㣬��Ŀ��ע�ؿ���ѧ�����û�ѧԭ�������ʵ����������������ù�ϵʽ����ɼ��㣮


 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ı���ģ����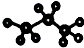 | |
| B�� | C2H4��C3H6һ����Ϊͬϵ�� | |
| C�� | 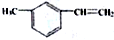 ���ڷ����� ���ڷ����� | |
| D�� | �ǻ��ĵ���ʽΪ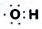 ��1mol-OH����7mol���� ��1mol-OH����7mol���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ܹ����� | |
| B�� | ��������������Ŀ����ʺͶ�����Ԫ�� | |
| C�� | �������κ�Ԫ�� | |
| D�� | ����ࡢ���������������ö��˽������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
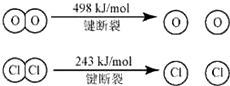
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢޢ� | B�� | �ڢܢ� | C�� | �٢ݢޢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na+��Mg2+��Al3+ ������������� | |
| B�� | HI��HBr��HCl �Ļ�ԭ�Ե����μ��� | |
| C�� | H2S��H2O��HF�����ȶ���������ǿ | |
| D�� | O2-��F-��Na+��Br-�İ뾶��С˳��Ϊ��Br-��O2-��F-��Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com