
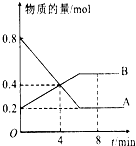
 某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据
某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析 (1)依据图象分析A为反应物,B为生成物,物质的量不变化说明反应达到平衡状态,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比写出化学方程式;
(2)依据反应速率V=$\frac{△c}{△t}$计算;根据C=$\frac{n}{V}$进行计算;
(3)图象分析随时间变化AB物质的量发生变化,说明未达到平衡8分钟时AB物质的量不变,说明反应达到平衡状态;
(4)平衡时反应物的转化率为:$\frac{反应物的变化量}{起始量}×100%$.
解答 解:(1)图象分析A为反应物,B为生成物,物质的量不变化说明反应达到平衡状态,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比,A物质的量变化=0.8mol-0.2mol=0.6mol;B变化物质的量=0.5mol-0.2mol=0.3mol,AB反应的物质的量之比2:1,所以反应的化学方程式:2A?B,故答案为:2A?B;
(2)反应开始至4min时,A物质的量变化=0.8mol-0.4mol=0.4mol,A的平均反应速率=$\frac{\frac{0.4mol}{2L}}{4min}$=0.05mol/L•min,C=$\frac{n}{V}$=$\frac{0.4mol}{2L}$=0.2mol/L,故答案为:0.05mol/L•min;0.2mol/L;
(3)图象分析随时间变化AB物质的量发生变化,说明未达到平衡,8分钟时AB物质的量不变,说明反应达到平衡状态,故答案为:否;=;
(4)平衡时反应物的转化率为:$\frac{反应物的变化量}{起始量}×100%$=$\frac{0.8-0.2}{0.8}×100%$=75%,故答案为:75%.
点评 本题考查了化学平衡影响因素分析,化学反应速率计算应用,主要是图象分析判断,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | 浓硫酸 | C. | NaCl | D. | NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,B为18电子分子,其结构式为
,B为18电子分子,其结构式为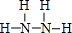 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2,H2S,O2 | B. | CH4,H2,CO | C. | NH3,H2,N2 | D. | HCl,Cl2,CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | |
| B. | NaHSO3 溶液中,c(H2SO3)>c(SO32-),加水稀释后离子浓度均减小 | |
| C. | 加入少量NaOH溶液,$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$减小,$\frac{c(O{H}^{-})}{c({H}^{+})}$的值增大 | |
| D. | 加入氨水至中性,则c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg | B. | N | C. | Be | D. | S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | 元素性质或结构 |
| X | 3p亚层上有1个空轨道 |
| Y | 第三周期元素形成的简单离子中半径最大 |
| Z | 短周期中原子最容易失电子 |
| A. | 氢化物的稳定性:X<Y | B. | 单质与水反应的难易程度:Y>Z | ||
| C. | 单质的熔点:X<Y<Z | D. | X、Y、Z的氧化物晶体类型相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com