
分析 (1)根据量热计的构造和实验步骤来确定实验的仪器;中和热测定实验成败的关键是保温工作;
(2)为了保证HCl完全反应,碱应过量;
(3)中和热的测定中,需要测出反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度;先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$QkJ/mol计算出反应热;
解答 解:(1)中和热测定的实验中,用到的玻璃仪器有大烧杯、小烧杯、温度计、量筒、胶头滴管,环形玻璃搅拌棒;大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失;
故答案为:温度计、胶头滴管;环形玻璃搅拌棒;保温、隔热、减少实验过程中热量的损失;
(2)NaOH的浓度大于HCl的浓度,使盐酸完全被中和,减少了盐酸挥发对实验的影响;
故答案为:保证盐酸完全被中和;
(3)中和热的测定中,需要测出反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度,所以总共需要测量3次;
0.50mol•L-1HCl和0.55mol•L-1的NaOH溶液各50mL进行中和反应,生成水的物质的量为0.05L×0.50mol•L-1=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值△t,则生成0.025mol水放出的热量为Q=m•c•△t=100g×4.18J/(g•℃)×△t=100×4.18×△t×10-3kJ,所以实验测得的中和热为:△H=-$\frac{100×4.18×△t×1{0}^{-3}}{0.025}$kJ/mol;
故答案为:100×4.18×△t×10-3;-$\frac{100×4.18×△t×1{0}^{-3}}{0.025}$kJ/mol.
点评 本题考查热反应热的测定与计算,题目难度大,注意理解中和热的概念以及测定反应热的原理,试题培养了学生的分析能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④⑤ | C. | ②⑤⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤所需实验用品有漏斗、烧杯、玻璃棒、铁架台(带铁圈) | |
| B. | 过滤时把漏斗放在铁三脚架上 | |
| C. | 过滤时将玻璃棒斜靠在三层滤纸上 | |
| D. | 过滤时为了加快过滤速度,用玻璃棒搅拌过滤器中的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O3?2H++CO32- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | BaOH)2?Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
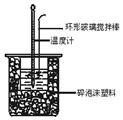 中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )
中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( )| A. | 改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同 | |
| B. | 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌 | |
| C. | 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失 | |
| D. | 实验中应记录测量出的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e |
| 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃[ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 起始温度T1/℃ | 终止温度T2/℃ | 平均温度差T2-T1/℃ | △H | ||
| 盐酸 | NaOH | 平均值 | ||||
| 1 | 26.2 | 26.0 | 26.1 | 29.2 | ------- | ------- |
| 2 | 25.9 | 25.9 | 25.9 | 29.2 | ||
| 3 | 26.4 | 26.2 | 26.3 | 29.5 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com