
| A. | 0.9 mol/L | B. | 1.8 mol/L | C. | 0.7mol/L | D. | 0.5mol/L |
分析 混合溶液中存在电荷守恒,即3c(Al3+)+2c(Mg2+)=2c(SO42-),溶液中H+、OH-离子浓度较小,可忽略不计,以此解答该题.
解答 解:含有MgSO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,Mg2+的物质的量浓度为0.3mol/L,
溶液中存在电荷守恒,即3c(Al3+)+2c(Mg2+)=2c(SO42-),
则c(SO42-)=$\frac{2×0.3mol/L+3×0.4mol/L}{2}$=0.9mol/L,
故选A.
点评 本题考查物质的量浓度的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握相关计算公式的运用,从电荷守恒的角度解答该题,难度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.8 g | B. | 11.2 g | C. | 5.6 g | D. | 8.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
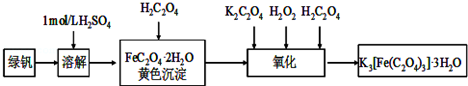
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 若起始时向容器中充入0.64 mol C,则达平衡时吸收的热量为0.12a kJ | |
| B. | 恒温,如果压缩容器体积,B的浓度和体积分数均不变 | |
| C. | 若起始时向容器中充入 0.64 mol A 和 0.64 mol B,则达平衡时 n(C)<0.48 mol | |
| D. | 恒温、恒容,向平衡体系中再充入0.32 mol A,再次平衡时,B的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
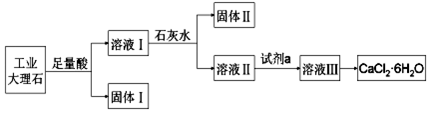
| A. | 固体Ⅰ中含有SiO2 | |
| B. | 使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为[Al(OH)4]- | |
| C. | 试剂a选用盐酸,从溶液Ⅲ得到CaCl2•6H2O的过程中,须控制条件防止其分解 | |
| D. | 若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2•6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
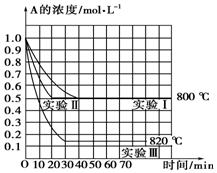 在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答:
在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com