
| 编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=$\frac{0.10}{{t}_{1}}$mol/(L•s) | |
| D. | 起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则反应将向逆反应方向进行 |
分析 A.根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;平衡常数只与温度有关,温度不变,平衡常数不变,故容器Ⅱ中得到平衡常数与容器I中相同;
B.增大压强,平衡向着气体体积减小的方向移动;
C.根据v=$\frac{△c}{△t}$进行计算;
D.计算出此时的Qc与K比较,判断反应进行的方向.
解答 解:PCl5(g)?PCl3(g)+Cl2(g),
A.I中K=$\frac{c(PC{l}_{3})•c(C{l}_{2})}{c(PC{l}_{5})}$=$\frac{\frac{0.1}{2}×\frac{0.1}{2}}{\frac{0.4-0.1}{2}}$≈0.03,平衡常数只与温度有关,温度不变,平衡常数不变,故容器Ⅱ中得到平衡常数与容器I中相同,容器III中K=$\frac{\frac{0.15}{2}×\frac{0.15}{2}}{\frac{0.4-0.15}{2}}$=0.045,即平衡常数K:容器Ⅱ<容器Ⅲ,故A错误;
B.容器Ⅱ与容器Ⅰ相比,相当于增大压强,平衡左移,PCl5的转化率减小,即PCl5的转化率:容器Ⅱ<容器Ⅰ,故B错误;
C.反应到达平衡时,反应的PCl5的物质的量为0.1mol,故v(PCl5)=$\frac{\frac{0.1mol}{2L}}{{t}_{1s}}$=$\frac{0.05}{{t}_{1}}$mol/(L•s),故C错误;
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl30.45 mol和Cl20.10 mol,则此时Qc=$\frac{\frac{0.45}{2}×\frac{0.10}{2}}{\frac{0.30}{2}}$=0.075>0.045,故平衡逆向移动,故D正确;
故选D.
点评 本题考查化学平衡移动原理及平衡常数的相关计算,难度中等.注意根据浓度商与平衡常数的比较判断反应进行的方向.


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:填空题
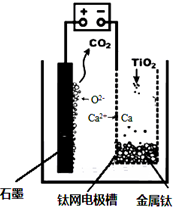 工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O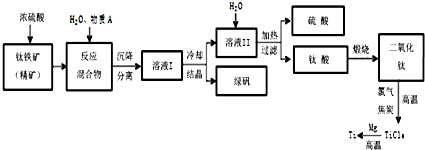
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 电池的总反应式:Cd+2NiOOH+2H2O$?_{充电}^{放电}$2Ni(OH)2+Cd(OH)2 | |
| B. | 电池充电时,镉元素被还原 | |
| C. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| D. | 电池充电时,电池的负极和电源的正极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量,②最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
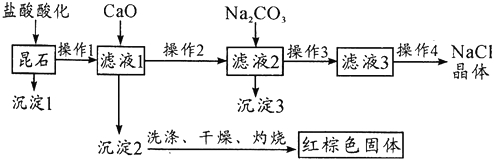
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com