
用1 L 1.0 mol·L-1 NaOH溶液吸收0.8 mol CO2,所得溶液中的CO 和HCO
和HCO 的物质的量浓度之比是( )
的物质的量浓度之比是( )
A.1∶3 B.2∶1
C.2∶3 D.3∶2
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
下列离子方程式错误的是
A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42 - =BaS04↓+2H2O
B.酸性介质中KMnO4氧化 H2O2:2MnO4- +5H2O2+6H+ = 2Mn2++5O2↑+ 8H2O
C.等物质的 量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
量的MgCl2、Ba(OH)2 和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e- = PbO2+4H++SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是
A.lmol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L0.5 mol • L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mo l Na2O2固体中含离子总数为4NA
l Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体 中氢原子的个数为6 NA
中氢原子的个数为6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.一定条件下,1.5 mol H2和0.5 mol N2充分反应后可得到NH3的分子数为NA
B.足量的Fe与Cl2反应生成0.1 mol产物时失去的电子数为0.3NA
C.常温常压下,18 g H2O含有的电子总数为8NA
D.标准状况下,22.4 L的己烯中含有的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
大气中CO2的含量增多会引起“温室效应”,你认为造成大气中CO2含量增多的主要原因是( )
A.植物的呼吸与腐烂放出CO2
B.人类和动物呼吸放出CO2
C.工业上大量燃烧含C燃料
D.建筑工业的发展使大量碳酸盐分解
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列物质中互为同分异构体的有________;互为同素异形体的有________;互为同位素的有________;互为同一物质的有________(填序码):
(1)液氯 (2)氯气 (3)白磷 (4)红磷 (5)35Cl (6)37Cl
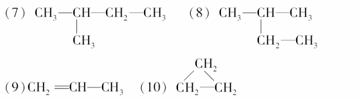
查看答案和解析>>
科目:高中化学 来源: 题型:
以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高的特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示,下列关于直接氨固体氧化物燃料电池的说法正确的是( )
A.该电池工作时的总反应为4NH3+5O2===4NO+6H2O
B.固体氧化物作为电池工作的电解质,其作用是让电子在电池内移动
C.电池工作时,在接触面上发生的电极反应为2NH3+3O2--6e-===N2+3H2O
D.外电路的电流方向为从电极a流向电极b

查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO →I2 MnO
→I2 MnO →Mn2+ HNO2→NO
→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( )
A.H2O2 B.IO
 C.MnO
C.MnO D.HNO2
D.HNO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com