
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.分析 (1)氢氧燃料电池工作时,通入氢气的电极为负极,发生氧化反应,在碱性溶液中,电极方程式为H2-2e-+2OH-=2H2O,通入氧气的电极为正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,总反应式为2H2+O2=2H2O,据此分析;
(2)甲醇燃料电池,甲醇在负极失电子发生氧化反应,氧气在正极放电,酸性条件下生成水;
根据甲醇的燃烧热计算2mol甲醇完全燃烧放出的热量,结合原电池产生的电能计算;
解答 解:(1)A、a电极通入氢气,发生氧化反应,应是负极,原电池工作时OH-移向负极,故A错误;
B、通入氧气的电极为正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,故B正确;
C、电极总反应式为2H2+O2=2H2O,不是在点燃的条件下反应,故C错误;
D、氢氧燃料电池可分别在两级上通入氢气和氧气,是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置,故D正确.
故答案为:AC;
(2)酸性条件下甲醇燃料电池的总反应式为:CH3OH+$\frac{3}{2}$O2═CO2+2H2O①,酸性条件下该燃料电池的正极反应式为$\frac{3}{2}$O2+6H++6e-═3H2O②,①-②得电池负极反应式为:CH3OH+H2O-6e-═CO2+6H+;该燃料电池的理论效率为$\frac{702.1kJ}{726.5kJ}$×100%=96.6%.
故答案为:CH3OH+H2O-6e-═CO2+6H+;$\frac{3}{2}$O2+6H++6e-═3H2O;96.6%.
点评 本题考查了原电池和电解池原理,明确正负极、阴阳极上得失电子是解本题关键,难点是电极反应式的书写,电极反应式要结合溶液的酸碱性书写,为易错点.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:多选题
| A. | 非金属氧化物都是酸性氧化物 | |
| B. | 一种元素可以组成单质,也可以组成混合物 | |
| C. | 电解质电离时生成的阳离子含有氢离子的化合物叫酸 | |
| D. | 碱性氧化物一定是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
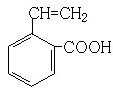 乙烯苯甲酸结构如图:
乙烯苯甲酸结构如图: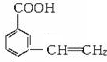 ,
,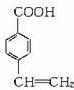 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A. | 正常人体血液中,HCO3-的水解程度小于电离程度 | |
| B. | 人体发生酸中毒时,可饮用碳酸饮料缓解 | |
| C. | pH=7.00的血液中,c(H2CO3)=c(HCO3-) | |
| D. | 常温下pH=7.40的血液稀释至pH=7.35,c(H+)•c(OH-) 一定不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(g)+O2(g)═SO2(g)△H1,S(s)+O2(g)═SO2(g)△H2;则:△H1>△H2 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol,则含20gNaOH的溶液与稀盐酸完全反应,放出的热量为28.7kJ | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,△S>0,则:该反应任何温度下都能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯 | B. | 乙二醇(HO-CH2-CH2-OH) | ||
| C. | 丙烷 | D. | 甲酸甲酯(HCOOCH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入澄清石灰水中 | B. | Na2CO3溶液中滴入HCl溶液 | ||
| C. | 硫酸中加入锌粉 | D. | 铁丝在氯气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com