
【题目】(1)氢氧燃料电池是符合绿色化学理念的新型发电装置。如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。其正极反应方程式为________________________,若将负极材料改为CH4,写出其负极反应方程式_________________________。

(2)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2molL﹣1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为____________________;每消耗3.4g NH3转移的电子数目为_________。
(3)图为青铜器在潮湿环境中因发生电化学反应而被腐蚀的原理示意图。

①腐蚀过程中,负极是_______(填图中字母“a”或“b”或“c”);
②环境中的Cl- 扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为______________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_______L(标况)。
【答案】O2+2H2O+4e-=4OH- CH4+10OH--8e-=CO32-+7H2O 2NH3+6OH--6e-=N2+6H2O 0.6NA c 2Cu2++3OH-+ Cl-=Cu2 (OH)3Cl↓ 0.448L
【解析】
(1)装置图分析为原电池反应,通氢气的电极为负极,氢气失电子发生氧化,反应在碱性溶液中生成水,通入氧气的电极为原电池正极,氧气得到电子发生还原反应生成氢氧根离子,若将负极材料改为CH4,负极为燃料甲烷失电子发生氧化反应,写出方程式;
(2)电池反应为: 4NH3+3O2=2N2+6H2O,该电池负极是氨气失电子生成氮气,写出方程式;根据消耗NH3的物质的量,计算转移的电子数;
(3) ①根据原电池相关原理,进行分析;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2 (OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2 (OH)3Cl沉淀;
③计算生成Cu2 (OH)3Cl沉淀的物质的量,再转化为氧气,进行相应计算。
(1)装置图分析为原电池反应,通氢气的电极为负极,氢气失电子发生氧化,反应在碱性溶液中生成水,通入氧气的电极为原电池正极,氧气得到电子发生还原反应生成氢氧根离子,正极电极反应为:O2+2H2O+4e-=4OH-;若将负极材料改为CH4,负极为燃料甲烷失电子发生氧化反应,负极的电极反应方程式为: CH4+10OH--8e-=CO32-+7H2O,故答案为:O2+2H2O+4e-=4OH-;CH4+10OH--8e-=CO32-+7H2O;
(2)电池反应为: 4NH3+3O2=2N2+6H2O,该电池负极是氨气失电子生成氮气,反应的电极反应式为2NH3+6OH--6e-=N2+6H2O;反应中2mol氨气反应电子转移6mol电子,每消耗3.4gNH3物质的量=![]() , 转移的电子数为0.6NA,故答案为:2NH3+6OH--6e-=N2+6H2O;0.6NA;
, 转移的电子数为0.6NA,故答案为:2NH3+6OH--6e-=N2+6H2O;0.6NA;
(3)①根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,故答案为:c;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2 (OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2 (OH)3Cl沉淀,离子方程式为2Cu2++3OH-+ Cl-=Cu2 (OH)3Cl↓,故答案为:2Cu2++3OH-+ Cl-=Cu2 (OH)3Cl↓;
③n[Cu2 (OH)3Cl] =![]() ,根据转移电子得n(O2)=
,根据转移电子得n(O2)=![]() ,V(O2)=
,V(O2)= ![]() ,故答案为:0.448L。
,故答案为:0.448L。


科目:高中化学 来源: 题型:
【题目】对于平衡体系:aA(g)+bB(g)![]() cC(g)+dD(g);正反应放热,有下列判断,其中正确的是( )
cC(g)+dD(g);正反应放热,有下列判断,其中正确的是( )
A.若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.6倍,则a+b<c+d
B.若从正反应开始,A、B的初始物质的量之比为1:1,则平衡时A、B的转化率一定相等
C.若平衡体系中共有气体M mol,再向其中充入b mol B,达到平衡时气体总物质的量为(M+b)mol,则a+b>c+d
D.若从正反应开始,平衡时A、B的转化率相等,则投入A、B物质的量之比为a:b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述不正确的是( )
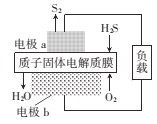
A.电池工作时,化学能转化为电能和热能
B.电极b上发生的电极反应式为O2+ 4e+4H+=2H2O
C.a是负极,电池工作时,电子的流动方向是:电极a→负载→电极b→质子膜→电极a
D.当电路中通过4mol电子时,有4molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.12C、13C和14C互为同位素,他们的放射性可用于考古断代,可测定生物体死亡的年代
B.合成纤维是利用自然界的纤维材料通过化学合成方法得到的
C.研制出性能优良的催化剂可以使反应的温度降低,从而起到很好的节能效果
D.碰撞理论和过度态理论是常用的化学反应速率理论,其中过渡态理论可解释温度、浓度等对化学反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.乙烯的球棍模型为![]()
B.CH2=CH—CH3分子中,最多有7个原子共面
C.用溴水或酸性KMnO4溶液可以区分甲烷和乙烯,也可以除去甲烷中的乙烯杂质得到纯净甲烷
D.C2H4和SO2都能使溴水褪色,又能使酸性KMnO4溶液褪色,并且化学反应原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。25 ℃时,向0.100 mol·L1 Na2C2O4溶液中缓缓通入HCl气体(忽略溶液体积的变化)。下列指定溶液中微粒的物质的量浓度关系正确的是
A.0.100 mol·L1 Na2C2O4溶液中:c(C2O42)>c(HC2O4)>c(OH)>c(H+)
B.pH=7的溶液中:c(Cl-)=c(HC2O4)+2c(H2C2O4)
C.c(Cl-)=0.100 mol·L1溶液中:c(OH)c(H+)=c(H2C2O4)c(C2O42)
D.c(HC2O4)=c(C2O42)的酸性溶液中:c(Cl-)+c(HC2O4)<0.100 mol·L1+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机化合物的结构简式如图所示,下列说法不正确的是( )
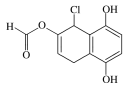
A.能发生银镜发应
B.能与FeCl3溶液发生显色反应
C.1 mol该物质最多可与4 mol NaOH反应
D.与NaHCO3、Na2CO3溶液均能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测定其相对分子质量,得如图一所示的质谱图;
③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是1∶2∶3。试回答下列问题:
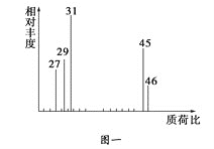

(1)有机物A的相对分子质量是________。
(2)有机物A的实验式是________。
(3)A的分子式是_______________________________________。
(4)A的结构简式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①0.2mol/LNaOH溶液和②0.2mol/L HX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X—)。则:
(1)①中由水电离出的c(OH)-___②中由水电离出的c(H+)。(填“>”、“=”或“<”)
(2)上述混合液中共存在___种粒子。且:c(HX)___c(X-)。(填“>”、“=”或“<”,下同)c(HX)+c(X-)___0.1mol/L(忽略体积变化)
请根据电荷守恒写出一个用离子浓度表示的等式:___。
(3)上述混合液显___性(填“酸”、“碱”或“中”),其原因用离子方程式表示___。
(4)已知t℃,KW=1×10-13,则t℃(填“>”或“<”或“=”)___25℃。在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com