
| K1 | K2 | |
| H2SO3 | 1.3��10-2 | 6.3��10-8 |
| H2CO3 | 4.4��10-7 | 4.7��10-11 |
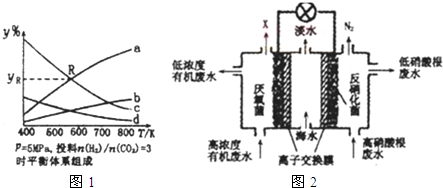
���� ��1���ٸ÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ��ʱCO2��H2�ĺ������ͣ�CH3CH2OH��H2O�ĺ�������ʼCO2 ��H2 �����ʵ���֮��1��3���У�ƽ��ʱH2�ĺ�����CO2�ĺ���������CH3CH2OH��H2O��1��3���ɣ�ƽ��ʱH2O�ĺ�����CH3CH2OH������������
��R��Ϊa��c�Ľ��㣬���ʱa��H2O���ΪV����ôc��H2���ҲΪV�����ݷ���ʽ�еĹ�ϵ���CO2��CH3CH2OH������������������yR��
��2��H2CO3��HCO3-��HSO3-�ĵ���ƽ�ⳣ���ֱ��ǣ�4.40��10-7��4.7��10-11��6.3��10-8����������˳���ǣ�H2CO3��HSO3-��HCO3-����ѧ��Ӧ��ѭǿ��������Ĺ��ɣ�
��3��SrSO4ת��ΪSrCO3�ɽ��������ӷ���ʽ����ɵõ����ӷ���ʽSrSO4��s��+CO32-��aq��?SrCO3��s��+SO42-��aq���жϣ��Դ˼��㣻
��4����ԭ����У���������ӵõ��ӷ�����ԭ��Ӧ�����ұ�װ���е缫b���������缫��ӦʽΪ2NO3-+10e-+12H+=N2��+6H2O�����װ�õ缫a�Ǹ������������л���ʧ���ӷ���������Ӧ���л��������������������ɶ�����̼���缫��ӦʽΪC6H10O5-24e-+7H2O�T6CO2��+24H+��
��� �⣺��1���ٸ÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ��ʱCO2��H2�ĺ������ͣ�CH3CH2OH��H2O�ĺ�������ʼCO2 ��H2 �����ʵ���֮��1��3���У�ƽ��ʱH2�ĺ�����CO2�ĺ���������CH3CH2OH��H2O��1��3���ɣ�ƽ��ʱH2O�ĺ�����CH3CH2OH������������
����a������b���¶����ߺ�������������a�ĺ����ߣ���������a��ʾH2O������b��ʾCH3CH2OH��
����c������d���¶����ߺ�����С��������c�ĺ����ߣ���������c��ʾH2������d��ʾCO2��
�ʴ�Ϊ��H2O��
��2CO2��g��+6H2��g��=CH3CH2OH��g��+3H2O��g����
R��Ϊa��c�Ľ��㣬���ʱa��H2O���Ϊ6V����ôc��H2���ҲΪ6V�����ݷ���ʽ��֪CO2Ϊ$\frac{6V}{6}$=2V��C2H5OHΪ$\frac{6V}{3}$=2V��
����R���Ӧ���������yR=$\frac{6V}{6V+6V+2V+2V}$��100%=37.5%��
�ʴ�Ϊ��37.5%��
��2����ѧ��Ӧ��ѭǿ��������Ĺ��ɣ����ԣ�HSO3-��HCO3-����Na2CO3��Һ�м�������NaHSO3��Һ����Ӧ�����ӷ���ʽΪCO32-+HSO3-=HCO3-+SO32-���ʴ�Ϊ��CO32-+HSO3-=HCO3-+SO32-��
��3����������Ksp��С��֪��SrSO4ת����SrCO3���ܽ��Բ�ͬ����Ӧ������ܵķ�����У����ݳ���ת��д�����ӷ���ʽΪ��SrSO4��s��+CO32-��aq��?SrCO3��s��+SO42-��aq�����÷�ӦΪSrSO4��s��?Sr2+��aq��+SO42-��aq��Ksp=2.5��10-7����SrCO3��s��?Sr2+��aq��+CO32-��aq���ڣ��÷�ӦΪ��-�ڵõ�����ƽ�ⳣ��Ϊ��$\frac{2.5��1{0}^{-7}}{2.5��1{0}^{-9}}$=100��
�ʴ�Ϊ��100��
��4���ٸ�ԭ����У���������ӵõ��ӷ�����ԭ��Ӧ���缫��ӦʽΪ2NO3-+10e-+12H+=N2��+6H2O�����ұ�װ���е缫b���������ʴ�Ϊ������
�����װ�õ缫a�Ǹ������������л���ʧ���ӷ���������Ӧ���л��������������������ɶ�����̼���缫��ӦʽΪC6H10O5-24e-+7H2O�T6CO2��+24H+���ʴ�Ϊ��C6H10O5-24e-+7H2O�T6CO2��+24H+��
���� ���⿼���Ϊ�ۺϣ��漰ƽ�ⳣ�������ܵ���ʵ��ܽ�ƽ������֪ʶ����Ŀ�Ѷ��еȣ���������������ѧ���ķ������������������Ӧ����ѧ֪ʶ��������ע����ػ���֪ʶ�Ļ��ۣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��AlCl3��Һ�У�Na+��NH4+��S2O32-��SO42- | |
| B�� | ʹpH��ֽ����ɫ����Һ�У�Cu2+��NO3-��Fe3+��SO42- | |
| C�� | �����۷�Ӧ�ų���������ɫ��Һ�У�Na+��Al3+��SO42-��NO3- | |
| D�� | ������$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1��10-12����Һ�У�K+��AlO2-��Na+��CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ���и��������У���������ͼ��ʾת����ϵ���ǣ�������
���и��������У���������ͼ��ʾת����ϵ���ǣ�������| ѡ�� | �� | �� | �� | �� |
| A | NH3 | Cl2 | N2 | H2 |
| B | Fe | H2O | Fe2O3 | CO |
| C | Al��OH��3 | NaOH | NaAlO2 | CO2 |
| D | Br2 | FeCl2 | FeBr3 | Cl2 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| ʵ����� | ʵ�� | Ԥ������ͽ��� |
| ʵ��� | ��ʵ��I���ռ����������ȼ | �ܰ���ȼ�ա���������ɫ����ٸ�����Ϊ���� |
| ʵ��� | ȡʵ��I�еİ�ɫ�����ϴ�ӣ����������˿�ɾȥ��ϡ���� | �������ݣ�����ȫ���ܽ⣻��ɫ��������ܺ���MgCO3 |
| ʵ��� | ȡʵ��I�еij���Һ�������м�������CaCl2��Һ | ������ɫ��������Һ�д��ڴ˿�ɾȥ��CO32-���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | ���� | ��ʼʱ���ʵ��� mol | ƽ��ʱ���ʵ���/mol | ƽ�ⳣ����K�� | |
| Fe2O3 | CO | Fe | |||
| 1 | ���� | 0.5 | 1.5 | 0.8 | K1 |
| 2 | ���� | 2 | 3 | m | K2 |
| 3 | ���� | 1 | 1.5 | n | K3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����Ӧ�úʹ������Ļ��������������������Ҫ���壮
����Ӧ�úʹ������Ļ��������������������Ҫ���壮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ӦN2��g��+3H2��g��?2NH3��g����H=-92kJ/mol �ų�����9.2KJʱ��ת�Ƶ���0.6 NA | |
| B�� | 7.2g CaO2�����������Ӻ�����������Ϊ0.3NA | |
| C�� | ��״���£�11.2L���к���̼�������ĿΪ3NA | |
| D�� | 0.1mol H2O2�����к����Թ��ۼ���ĿΪ0.3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2��3��6 | B�� | 6��3��2 | C�� | 1��2��3 | D�� | 3��2��1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com