
分析 加热发生反应2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,导致固体质量减少,根据方程式利用差量法计算NaHCO3的质量,进而计算NaHCO3的质量分数,从而求出加热后碳酸钠的物质的量,结加入盐酸的物质的量进行过量问题判断,最后得出二氧化碳的体积,由此分析解答.
解答 解:设混合物中含有xg NaHCO3,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O 固体质量减少△m
2×84g 62g
xg 19g-15.9g=3.1g
$\frac{2×84g}{xg}=\frac{62g}{3.1g}$,解得x=8.4g,
w(NaHCO3)=$\frac{8.4g}{19g}$×100%=44.2%,
所以生成Na2CO3的物质的量为:0.05mol,原混合物中碳酸钠的物质的量为:$\frac{19-8.4}{106}$=0.1mol,所以加热后碳酸钠的总物质的量为:0.15mol,而75mL 2mol/L的盐酸溶液的物质的量为:75×10-3×2=0.15mol,则两者恰好完全反应生成0.15molNaHCO3和0.15molNaCl,如果再接着滴入同浓度盐酸溶液25mL,盐酸的物质的量为:25×10-3×2=0.05mol,所以盐酸不足,碳酸氢钠过量,生成0.05mol的二氧化碳,体积为:1.12L,故答案为:44.2%;NaHCO3和NaCl;1.12.
点评 本题考查混合物的计算,关键理解固体质量减少的原因,注意差量法的运用,难度不大.


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:推断题
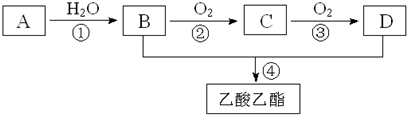
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32 g O2含有氧原子数为NA | |
| B. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| C. | 18g H2O中含有的电子数为10NA | |
| D. | 0.5mol•L-1CaCl2溶液中含Cl-数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,电离平衡常数越小,表示弱电解质的电离能力越弱 | |
| B. | 相同条件下,化学平衡常数越大,表示该反应的反应速率越大 | |
| C. | 其它条件不变时,升高温度,化学平衡常数一定增大 | |
| D. | 多元弱酸各步电离平衡常数相互关系为K1<K2<K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维、棉花、油脂、ABS树脂都是由高分子化合物组成的物质 | |
| B. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| C. | 开发核能、太阳能等新能源,推广基础甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 | |
| D. | 阴极射线、α粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9:2 | B. | 1:9 | C. | 10:1 | D. | 9:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com