
| A、将氯化铁饱和溶液逐滴滴入氢氧化钠稀溶液中,边滴边搅拌,可获得氢氧化铁胶体 |
| B、不能用乙醇萃取碘水中的碘是因为碘在水中溶解度比在乙醇中大 |
| C、实验室可通过蒸馏的方法除去自来水中含有的氯离子等杂质制蒸馏水 |
| D、浓硫酸不慎溅到皮肤上,应该立即用大量水冲洗,然后涂上稀NaOH溶液 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
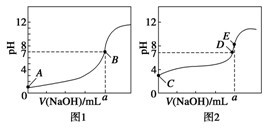
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
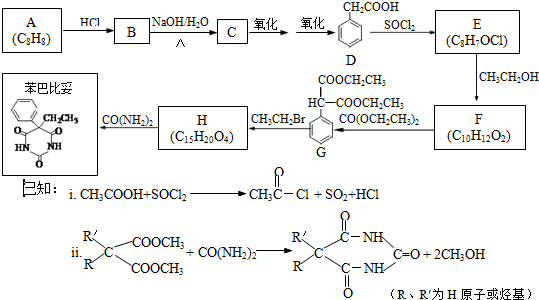
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=5.6的由CH3COOH与CH3COONa组成的混合溶液中:c(Na+)<c(CH3C00-) |
| B、将pH=a的醋酸稀释为pH=a+1的过程中,c(OH-)不断增大 |
| C、等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和时,a+b=14 |
| D、浓度均为o.1 mol-1的CH3COOH溶液和氨水等体积混合后:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com