
【题目】A、B、C、D、E是原子序数依次增大的5种短周期元素。A与D、C与E分别同主族,E原子的最外层电子数比次外层少2个。A、B两元素可形成BA3气体分子甲,甲能使湿润的红色石蕊试纸变蓝且每个分子内含10个电子。请回答下列问题:
(1)气体甲溶于水所得溶液呈碱性的原因(用电离方程式表示)______________。
已知:甲、乙、丙、丁4种物质之间的转化关系如下图(注:反应条件或产物已略去)。
甲![]() 乙
乙![]() 丙
丙![]() 丁
丁
请写出从甲→乙转化的化学方程式____________________________________________。
(2)用电子式表示离子化合物D2C2的形成过程____________________________________。
(3)DAEC3和DAEC4的溶液均呈现_______(填:“酸”“碱”“中”)性,在DAEB3溶液中离子浓度由大到小的顺序是________________________________;如果将两种溶液混合后发生反应的离子方程式为____________________________________。
(4)已知A2EC3和A2EC4两种酸中酸性更强的是后者,请从分子结构和性质的关系角度解释这种差异产生的原因___________________________________。
(5)B元素的三氯化物(BCl3)常温下是一种淡黄色液体,具有三角锥型的分子结构。下列关于BCl3分子的描述中不正确的是_________________。
A.BCl3分子中B显-3价、采用SP3杂化
B.BCl3分子间可形成氢键,比PCl3难挥发
C.B、C元素的电负性B< C ,第一电离能B>C
D.BCl3遇水发生水解反应产物是BH3和HClO
【答案】NH3·H2O![]() NH4++OH- 4NH3+5O2
NH4++OH- 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O ![]() 酸性 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) HSO3-+ H+== SO2↑+ H2O H2SO3、H2SO4都是二元酸,H2SO3分子中含1个非羟基氧原子、属于中强酸,而H2SO4分子中含2个非羟基氧原子、属于强酸;②H2SO4分子中S的化合价较高,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强。 B
酸性 c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-) HSO3-+ H+== SO2↑+ H2O H2SO3、H2SO4都是二元酸,H2SO3分子中含1个非羟基氧原子、属于中强酸,而H2SO4分子中含2个非羟基氧原子、属于强酸;②H2SO4分子中S的化合价较高,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强。 B
【解析】
E原子的最外层电子数比次外层少2个,E的次外层,只能是L层,容纳8个电子,最外层则有6个电子,E为S元素,则C为O元素。A、B两元素可形成BA3气体分子甲,甲能使湿润的红色石蕊试纸变蓝且每个分子内含10个电子。BA3为NH3,则B元素为N,A元素为H。A和D同主族,根据D的原子序数比O大,则D为Na。
(1)氨气溶于水后生成NH3·H2O,会电离出OH-使溶液呈现碱性,答案为NH3·H2O![]() NH4++OH-;氨气连续两次氧化,为工业制取硝酸的流程。NH3氧化到NO,NO再氧化成NO2,NO2和水反应生成硝酸。甲生成乙的反应为4NH3+5O2
NH4++OH-;氨气连续两次氧化,为工业制取硝酸的流程。NH3氧化到NO,NO再氧化成NO2,NO2和水反应生成硝酸。甲生成乙的反应为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(2)D2C2为Na2O2,用电子式表示Na2O2的形成过程,,其表达式为![]() ;
;
(3)DAEC3和DAEC4的溶液分别为NaHSO3溶液和NaHSO4溶液。NaHSO3溶液中,HSO3-既电离又水解,HSO3-![]() H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O![]() H2SO3+OH-,但是电离程度大于水解程度,因此溶液呈现酸性。NaHSO4为强酸的酸式根离子,NaHSO4=Na++H++SO42-,溶液呈酸性,则两者均为酸性。NaHSO3溶液中,NaHSO3=Na++HSO3-,HSO3-既电离又水解,则c(Na+) >c(HSO3-);HSO3-电离程度大于水解程度,忽略水解,HSO3-
H2SO3+OH-,但是电离程度大于水解程度,因此溶液呈现酸性。NaHSO4为强酸的酸式根离子,NaHSO4=Na++H++SO42-,溶液呈酸性,则两者均为酸性。NaHSO3溶液中,NaHSO3=Na++HSO3-,HSO3-既电离又水解,则c(Na+) >c(HSO3-);HSO3-电离程度大于水解程度,忽略水解,HSO3-![]() H++SO32-,溶液中还存在水的电离,H2O
H++SO32-,溶液中还存在水的电离,H2O![]() H++OH-,则c(H+)>c(SO32-);另电解质的电离程度一般大于水的电离程度,c(SO32-)>c(OH-);综上有c(Na+) >c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。将两种溶液混合,则HSO3-会与H+反应,方程式为HSO3-+ H+== SO2↑+ H2O;
H++OH-,则c(H+)>c(SO32-);另电解质的电离程度一般大于水的电离程度,c(SO32-)>c(OH-);综上有c(Na+) >c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。将两种溶液混合,则HSO3-会与H+反应,方程式为HSO3-+ H+== SO2↑+ H2O;
(4)H2SO3和H2SO4的结构式分别为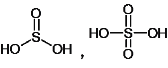 ,亚硫酸中只有1个非羟基氧原子,而硫酸中有2个非羟基氧原子。非羟基氧原子是吸电子原子,使得羟基中的电子更加偏向O,使氢原子更容易电离,酸性变强。此外硫酸中S的化合价更高,吸电子能力更强,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强;答案为H2SO3、H2SO4都是二元酸,H2SO3分子中含1个非羟基氧原子、属于中强酸,而H2SO4分子中含2个非羟基氧原子、属于强酸;②H2SO4分子中S的化合价较高,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强;
,亚硫酸中只有1个非羟基氧原子,而硫酸中有2个非羟基氧原子。非羟基氧原子是吸电子原子,使得羟基中的电子更加偏向O,使氢原子更容易电离,酸性变强。此外硫酸中S的化合价更高,吸电子能力更强,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强;答案为H2SO3、H2SO4都是二元酸,H2SO3分子中含1个非羟基氧原子、属于中强酸,而H2SO4分子中含2个非羟基氧原子、属于强酸;②H2SO4分子中S的化合价较高,使S-O键中的共用电子对偏向S更强烈一些,从而使O-H键的极性大于H2SO3,更易于电离出氢离子酸性更强;
(5)BCl3为NCl3。
A.NCl3分子中的中心原子N和Cl原子之间形成3个极性键,N原子的周围仍然存在一对孤电子对,故N原子的杂化方式为sp3杂化,A项正确,不符合题意;
B.NCl3分子中不含H原子,分子间只有分子间作用力,不含有氢键。B项错误,符合题意;
C.N元素和O元素同周期,同周期非金属元素的电负性从左到右,依次增强,则N的电负性小于O的电负性。基态N原子的价电子排布为2s22p3,基态O原子的价电子排布为2s22p4。N原子的p轨道为半满结构,更加稳定,第一电离能更大;C项正确,不符合题意;
D.NCl3发生水解反应,化学方程式为NCl3+3H2O=NH3+3HClO,D项正确,不符合题意;
综上答案为B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中国海军航母建设正在有计划、有步骤向前推进。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为_______________________.
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为______杂化,在有机物中C原子间可以形成双键,而硅烷中Si原子间难以形成双键的原因是_____________.

(3)海洋是元素的摇篮,海水中含有大量卤族元素。
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________(填元素符号)

②根据价层电子对互斥理论,预测ClO的空间构型为___________形,写出一个ClO的等电子体的化学符号___________.
(4)海底金属软泥是在洋海底蕴藏着大量的资源,含有硅、铁、锰、锌等。某种磁性氮化铁的晶胞结构如图所示,该化合物的化学式为________________,若晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为________g·cm3(用含a、c和NA的式子表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工业生产中应用广泛。
Ⅰ.某同学设计如下实验装置测定铜的相对原子质量(夹持和加热仪器已略去),并检验氯气的氧化性。

(1)该实验装置的连接顺序为:A连接________,B连接________(填字母)。
(2)乙装置a瓶中的溶液可以是_______
A.NaOH溶液 B.Na2S溶液 C.酸性KMnO4溶液 D.含少量KSCN的FeCl2溶液
(3)对丙装置进行加热前需要________ 。
(4)准确称量 m g CuO进行实验,当CuO完全反应后测出b中增重n g。则Cu的相对原子质量为________ (只要求列出算式)。该实验方案的装置有不合理之处,若不加以改正会导致测定结果________(填“偏大”、”偏小“或”不变“)。
Ⅱ.研究发现Cu与稀盐酸不反应,但在持续通入空气的条件下可反应生成CuCl2。
(5)已知Fe3+对该反应有催化作用,其催化原理如图所示:
![]()
则图中的M‘为________(填化学符号)
(6)向CuCl2溶液中通入H2S气体,可产生CuS沉淀,反应离子方程式为:Cu2++H2S=CuS(s)+2H+ , 则该反应的平衡常数K=________(保留一位小数)。已知:CuS溶度积KSP=1.0×10-36 , H2S电离常数Ka1=1.3×10-7 , Ka2=7.0×10-15。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了10种元素在元素周期表中的位置:
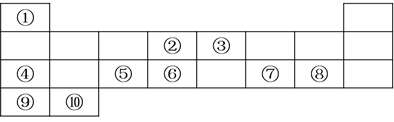
请用相应的化学用语回答下列问题:
(1)元素②在元素周期表中处于第________________周期,第________________族;
(2)上述10种元素中,金属性最强的元素的符号为________________,最高价氧化物对应水化物中,酸性最强的物质的分子式为________________;
(3)②、③、⑥三种元素按原子半径由大到小的顺序排列为________________(用元素符号表示);
(4)④在空气中燃烧的化学方程式为________________;
(5)元素④、⑦的最高价氧化物对应水化物发生反应的离子方程式为________________;
(6)⑧与⑨形成的化合物的电子式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氟利昂-12(CF2Cl2)是甲烷的氯、氟卤代物,它有2种同分异构体
B.对甲基苯甲醛(![]() )使高锰酸钾酸性溶液褪色,说明它含有醛基
)使高锰酸钾酸性溶液褪色,说明它含有醛基
C.溴水可以区分苯和乙酸
D.糖类是食物组成中的重要部分,也是产生能量最高的营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“清肺排毒汤”来源于中医经典方剂组合,对新冠肺炎病毒感染的轻型、普通型的治疗具有良好的效果。其中的一味中药黄芩的有效成分的结构简式如图所示,下列说法错误的是( )
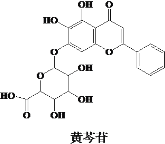
A.黄芩苷是芳香化合物,其分子式为C21H18O11
B.黄芩苷可发生取代、加成、氧化反应
C.黄芩苷分子中苯环上的一氯代物有3种
D.1 mol黄芩苷与足量钠反应,所得H2的体积在标准状况下为67.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. ![]() σ键和π键比例为7:1
σ键和π键比例为7:1
B. 某元素气态基态原子的逐级电离能(kJmol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
C. C22﹣与O22+互为等电子体,1 mol O22+中含有的π键数目为2NA, O22+的电子式可表示为 ![]()
D. 已知反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l),若该反应中有4 mol N﹣H键断裂,则形成的π键数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )
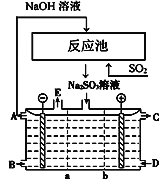
A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中________(填元素符号)的非金属性最强;________(填元素符号)的金属性最强,写出该元素的单质与水反应的离子方程式:___________________________________________________。
(2)表中元素③的原子结构示意图是____________。
(3)表中元素⑥、⑦的氢化物的稳定性顺序为
(4)表中元素最高价氧化物对应水化物酸性最强的是________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com