
【题目】第四周期中某些元素的相关化合物在化工、医药、材料等领域有着广泛应用
(1)现代化学中,常利用_________上的特征谱线来鉴定元素。Ga的外围电子排布式为:_____________________,基态Ga原子核外有______种运动状态不同的电子。
(2)锗、砷、硒、溴的第一电离能由大到小的顺序为____________(用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维掺杂剂,其熔点为-49.5℃,沸点为83.1℃,则其晶体类型为_________,中心原子的杂化类型为________;砷酸的酸性弱于硒酸,从分子结构的角度解释原因_______________________。
(3)铁能形成[Fe(Bipy)2C12]ClO4等多种配合物(Bipy结构如下图A)。

①该配合物中中心原子的化合价为________;与中心原子形成配位键的原子是________。
②与ClO4-互为等电子体的一种非极性分子是_______(举1例)。
③1 mol Bipy中所含σ键______mol。
(4)钛(Ti)被誉为“21世纪金属”,Ti晶体的堆积方式是六方最密堆积如图B所示,晶胞可用图C表示。设金属Ti的原子半径为a cm,空间利用率为__________。设晶胞中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),则B点原子的坐标为________________。
【答案】 原子光谱 4s24p1 31 Br>As>Se>Ge 分子晶体 sp3 H2SeO4的非羟基氧原子多,Se的正电性更高,羟基中的O原子的电子向Se偏移程度大,更容易电离出H+ +3 N 、Cl CCl4 (SiF4 等) 8 ![]() 或74% (
或74% (![]() ,
,![]() ,
,![]() )
)
【解析】试题分析:现代化学中,常利用原子光谱上的特征谱线来鉴定元素。原子核外电子的运动状态互不相同,有几个电子,就有几种运动状态。同一周期元素的第一电离能呈逐渐增大趋势,第IIVA和第VA元素因其原子结构较稳定,故其第一电离能高于同周期相邻的两种元素。
(1)现代化学中,常利用原子光谱上的特征谱线来鉴定元素。Ga的外围电子排布式为4s24p1,Ga是31号元素,故基态Ga原子核外有31种运动状态不同的电子。
(2)锗、砷、硒、溴的第一电离能由大到小的顺序为Br>As>Se>Ge;其中锗的化合物四氯化锗可用作光导纤维掺杂剂,其熔点为-49.5℃,沸点为83.1℃,其熔、沸点较低,故其晶体类型为分子晶体,中心原子锗原子形成4个σ键、无孤电子对,故其杂化类型为sp3;砷酸的酸性弱于硒酸,是因为H2SeO4的非羟基氧原子多,Se的正电性更高,羟基中的O原子的电子向Se偏移程度大,更容易电离出H+。
(3)①配合物[Fe(Bipy)2C12]ClO4的外界是ClO4-,内界有Bipy和Cl-两种配体,Bipy是电中性的,所以,中心原子的化合价为+3;两种配体中N和Cl有孤电子对,故与中心原子形成配位键的原子是N和Cl。
②ClO4-有5个原子、32个价电子,与ClO4-互为等电子体的有多种,其中属于非极性分子是CCl4和SiF4 等。
③Bipy分子中有N—N、N—H、N—C、C—H等4种σ键,注意2个C原子上分别连接1个H,故1 mol Bipy中所含σ键8mol。
(4)由Ti晶体的晶胞结构示意图可知,该晶胞为平行六面体,其底是菱形,金属Ti的原子半径为a cm,则底边长为2acm,底面的面积为2a![]() sin60
sin60![]() 。B点与底面连线的3个点构成正四面体,正四面体的高为
。B点与底面连线的3个点构成正四面体,正四面体的高为![]() ,所以晶胞的高为
,所以晶胞的高为![]() ,晶胞的体积为底面的面积与高的积,即
,晶胞的体积为底面的面积与高的积,即![]() ,根据均摊法可以求出该晶胞中有2个Ti原子,2个Ti原子的体积为
,根据均摊法可以求出该晶胞中有2个Ti原子,2个Ti原子的体积为![]() ,所以,原子的空间利用率为
,所以,原子的空间利用率为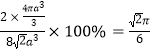 (或74%)。设晶胞中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),B点的高度为晶胞高度的一半,由B点向底面作垂线,垂足为中线的三等分点,则垂足的坐标为(
(或74%)。设晶胞中A点原子的坐标为(1,0,0),C点原子的坐标为(0,1,0),D点原子的坐标为(0,0,1),B点的高度为晶胞高度的一半,由B点向底面作垂线,垂足为中线的三等分点,则垂足的坐标为(![]() ,0),所以,B点原子的坐标为(
,0),所以,B点原子的坐标为(![]() )。
)。


科目:高中化学 来源: 题型:
【题目】在一定条件下,对于反应mA(g)+nB(g) ![]() cC(g)+dD(g),C物质的质量分数(C%)随温度升高或压强增大而减小。下列判断正确的是
cC(g)+dD(g),C物质的质量分数(C%)随温度升高或压强增大而减小。下列判断正确的是
A. 该反应为放热反应
B. (m+n) >(c+d)
C. 减小压强,平衡正向移动,平衡常数K值增大
D. 达到平衡后,增加A的物质的量,平衡正向移动,A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是( )
A.甲烷在空气中燃烧B.用光照射甲烷和氯气的混合气体
C.乙烯制备聚乙烯D.乙烯通入到溴的四氯化碳溶液,溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种高效清洁、极具发展潜力的能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知下列反应:
反应I:CH3CH2OH(g)+H2O(g) ![]() 2CO(g)+4H2(g) △H1
2CO(g)+4H2(g) △H1
反应Ⅱ:CO(g)+ H2O(g) ![]() CO2(g)+ H2(g) △H2
CO2(g)+ H2(g) △H2
反应Ⅲ:2 CO2(g)+ 6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H3
CH3CH2OH(g)+3H2O(g) △H3
反应Ⅳ:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) △H4
CH2=CH2(g)+4H2O(g) △H4
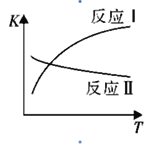
(1)反应I和反应II的平衡常数随温度变化曲线如图所示。则△H1 _________△H2(填“>”、“<”或“=”);△H3=_________(用△H1、△H2表示)。
(2)向2L密闭容器中充入H2和CO2共6mol,改变氢碳比[n(H2)/n(CO2)]在不同温度下发生反应III达到平衡状态,测得的实验数据如下表。分析表中数据回答下列问题:
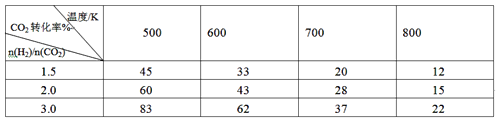
①温度升高,K值__________(填“增大”、“减小”、或“不变”)。
②提高氢碳比,K值____(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
③在700K、 氢碳比为1.5,若5min反应达到平衡状态,则0~5min用H2表示的速率为__________。
(3)反应III在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
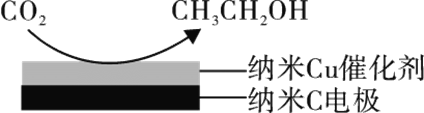
①阴极的电极反应式为________。
②从电解后溶液中分离出乙醇的操作方法为________。
(4)在一定条件下发生反应Ⅳ,测得不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,下列有关说法正确的为________(填序号)。
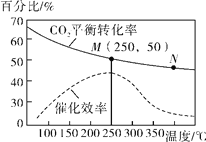
①不同条件下反应,N点的速率最大
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的平衡转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①海带等藻类物质经过处理后,可以得到碘水,向碘水中加入四氯化碳以提取碘单质的实验操作叫________,该操作需要的玻璃仪器有________。
②某NaCl样品中可能含有SO42-,CO32-,为检验杂质离子的存在,采取如下实验步骤:样品![]() 无明显现象
无明显现象![]() 无明显现象。则加入的试剂A为_______,B为_______,该现象证明样品中不含有____。
无明显现象。则加入的试剂A为_______,B为_______,该现象证明样品中不含有____。
③在后续实验中需要使用450mL0.5 mol·L- 1NaCl溶液,为配制该浓度NaCl溶液进行实验,需用托盘天平称取NaCl_______g。配制NaCl溶液时,若出现下列操作,会使配制浓度偏高的是(_____)
A.天平砝码己锈蚀 B.配制过程中未用蒸馏水洗涤烧杯和玻璃棒
C.转移溶液时有溶液溅出 D.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/3。
⑴此浓盐酸的物质的量浓度是多少?_______________(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL? ______________(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):_____________________ 。
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com