
| A. | H2和D2互为同位素 | B. | 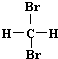 和 和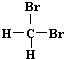 互为同分异构体 互为同分异构体 | ||
| C. | H、D、T互称为同素异形体 | D. | 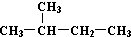 和 和 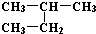 是同一种物质 是同一种物质 |
分析 A.质子数相同,中子数不同的原子互称同位素;
B.具有相同分子式而结构不同的化合物互为同分异构体;
C.同种元素形成的不同单质互为同素异形体;
D.根据物质的俗名、名称或化学式或主要成分分析判断,主要成分属于同一种物质要求其化学名称相同,化学式相同.
解答 解:A.H2和D2都是氢元素组成的,结构相同的单质,同位素指原子,故A错误;
B. 和
和 都为二溴乙烷,名称与结构简式一致,为同一种物质,故B错误;
都为二溴乙烷,名称与结构简式一致,为同一种物质,故B错误;
C.同素异形体为同种元素组成的不同单质,H、D、T 的质子数都是1,而中子数分别为0、1、2,且三者都是原子,则互为同位素,故C错误;
D. 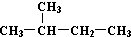 和
和 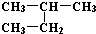 都为2-甲基丁烷,名称与结构简式一致,为同一种物质,故D正确;
都为2-甲基丁烷,名称与结构简式一致,为同一种物质,故D正确;
故选D.
点评 本题考查同位素、同分异构体、同素异形体、同一物质的区别,题目难度不大,注意把握概念的内涵与外延.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
 该反应中,氧化剂是Fe2O3,被还原的元素是Fe,还原产物是Fe,每消耗1molCO时,转移的电子的物质的量为2mol.
该反应中,氧化剂是Fe2O3,被还原的元素是Fe,还原产物是Fe,每消耗1molCO时,转移的电子的物质的量为2mol. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含NA个Fe(OH)3胶粒 | |
| B. | 将80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2 mol/L | |
| C. | 154g CCl4 在标准状况下的体积是22.4L | |
| D. | 在标准状况时,20ml NH3与60ml O2所含分子个数比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸钠大量用于染料和有机合成工业.用木屑制备亚硝酸钠的流程如下:
亚硝酸钠大量用于染料和有机合成工业.用木屑制备亚硝酸钠的流程如下:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{m-x+2}{m-n}$ | B. | $\frac{n-(m-x)}{m}$ | C. | $\frac{n(m-x+2)}{m}$ | D. | $\frac{n(m-x+2)}{m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
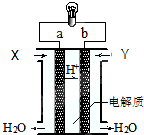
| A. | 正极的电极反应是:O2+2H2O+4e-=4OH- | |
| B. | a极是负极 | |
| C. | 电子由a通过灯泡流向b | |
| D. | 通入的气体Y为O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
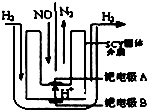 汽车尾气中NOx的消除及无害化处理引起社会广泛关注.
汽车尾气中NOx的消除及无害化处理引起社会广泛关注.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)将一定量固体A置于一个容器体积不变的密闭容器中发生如下反应:
(1)将一定量固体A置于一个容器体积不变的密闭容器中发生如下反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com