
| A. | 相同条件下,H2O电解产物H2和O2的物质的量之比为2:1 | |
| B. | 相同条件下,H2O电解产物H2和O2的质量之比为2:1 | |
| C. | 相同条件下,1molH2与1molO2的体积相同 | |
| D. | 相同条件下,1molH2与1molO2的质量不相同 |
分析 A.根据电解方程式可得出H2O电解产物H2和O2的物质的量之比;
B.根据m=nM计算电解水生成氢气和氧气的质量之比;
C.相同条件下气体摩尔体积相同,根据V=nVm可知等物质的量氢气和氧气具有相同体积;
D.根据m=nM计算1molH2与1molO2的质量.
解答 解:A.根据2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑可知,相同条件下H2O电解产物H2和O2的物质的量之比为2:1,故A正确;
B.H2O电解产物H2和O2的物质的量之比为2:1,根据m=nM可知H2O电解产物H2和O2的质量之=(2g/mol×2):(32g/mol×1)=1:8,故B错误;
C.相同条件下气体摩尔体积Vm相同,根据V=nVm可知1molH2与1molO2的体积相同,故C正确;
D.1molH2的质量为:2g/mol×1mol=2g,1molO2的质量为:32g/mol×1mol=32g,二者质量不同,故D正确;
故选B.
点评 本题通过电解原理考查物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积之间的关系即可解答,试题侧重基础知识的考查,有利于提高学生的化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C=C | C-C | C≡C | C-H |
| E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
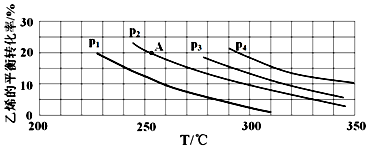
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 24gNaH中阴离子所含电子总数为2NA | |
| B. | 标准状况下,44.8LNO与22.4LO2混合后,气体中分子总数为2NA | |
| C. | 在0.lmol/L的K2CO3溶液中,阴离子数目大于O.1NA | |
| D. | 300mL2mol/L乙醇溶液中所含分子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碘化钠溶液中加入新制氯水可看到有紫黑色固体生成 | |
| B. | 向分别装有1gNa2CO3和NaHCO3固体的试管中滴入几滴水,温度高的为Na2CO3 | |
| C. | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,变红,说明样品变质 | |
| D. | 中和热测定时环形玻璃搅拌棒要不断顺时针搅拌,目的是为了混合均匀,充分反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
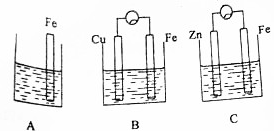 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 800 mL,93.6 g | B. | 1000 mL,93.6 g | C. | 1 000 mL,117 g | D. | 800mL,117 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④⑤ | C. | ②④⑤⑥ | D. | ②③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com